
【题目】已知:CO和H2在Co做催化剂、温度为160℃~200℃时,可以合成汽油(即分子中含5至8个碳原子的烷烃)。
(1)用CnH2n+2表示汽油,写出上述反应的化学方程式____________________(需配平)
(2)若向密闭的合成塔内通入CO和H2,恰好完全反应,此时塔内压强降至反应前的![]() ,通过计算说明是否生成汽油__________________。
,通过计算说明是否生成汽油__________________。
科目:高中化学 来源: 题型:
【题目】下列根据操作和现象所得出的结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝 | H2O2氧化性比I2强 |
B | 向Na2CO3溶液中加稀硫酸将产生的气体通入硅酸钠溶液中产生白色沉淀 | 非金属性:S>C>Si |
C | 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液不含NH4+ |
D | 将BaSO4浸泡在饱和Na2CO3溶液中,一段时间后过滤并洗涤沉淀,向沉淀中加入稀盐酸,有气泡产生 | Ksp(BaSO4)>Ksp(BaCO3) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质为常见有机物:
①甲苯 ②1,3﹣丁二烯 ③直馏汽油 ④植物油
填空:
(1)既能使溴水因发生化学变化褪色,也能使酸性高锰酸钾褪色的烃是____(填编号);
(2)能和氢氧化钠溶液反应的是______(填编号),写出该反应产物之一与硝酸酯化的化学方程式______.
(3)已知:环己烯可以通过1,3﹣丁二烯与乙烯发生环化加成反应得到:
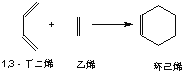
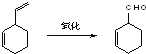
实验证明,下列反应中,反应物分子的环外双键比环内双键更容易被氧化:
现仅以1,3﹣丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
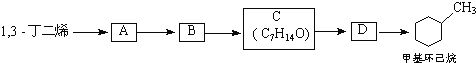
(a)写出结构简式:A______;B_____
(b)加氢后产物与甲基环己烷互为同系物的是_______
(c)1mol A与1mol HBr加成可以得到_____种产物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 1 mol Zn与足量该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A. 氯水中有下列平衡:Cl2+H2O![]() HCl+HClO,光照后氯水颜色变浅
HCl+HClO,光照后氯水颜色变浅
B. 合成氨工业使用高压以提高氨的产量
C. 对于H2(g)+I2(g)![]() 2HI(g),达平衡后,缩小容器体积可使体系颜色变深
2HI(g),达平衡后,缩小容器体积可使体系颜色变深
D. 汽水型饮料打开瓶盖后产生大量气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
A.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
B.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
C.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一密封体系中发生下列反应:N2+3H2![]() 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
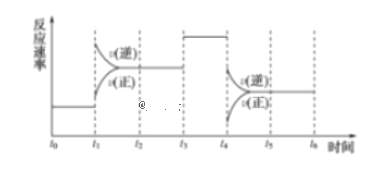
回答下列问题:
(1)处于平衡状态的时间段是___________、___________、___________。
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化:____________、___________、___________。
(3)下列各时间段时,氨的百分含量最高的是___________(填序号)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
II.830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:
(4)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。
(5)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)____v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数(Ka、Kb)、水的离子积常数(Kw)、盐的水解常数(Kh)是电解质溶液中的三大常数,学习中我们要注意他们的区别与联系,通过学习的相关知识请完成以下练习。
(1)已知:a.常温下,醋酸和NH3H2O的电离常数相同。
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
①CH3COONH4溶液呈_______性(填"酸"、"碱"或"中",下同)。
②NH4HCO3溶液呈________性,溶液中物质的量浓度最大的离子是______(填化学式)。
(2)室温时,若用盐酸滴定氨水,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____________(填数值)。
(3)100℃时,Kw=1.0×10-12,该温度下测得0.1mol/L Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为__________________________________
②该温度下,将0.01mol/L H2A 溶液稀释20倍后,溶液的pH=__________
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显______(填“酸”、“碱”或“中”)性,c(CN-)_____(填“>”、“<”或“=”)c(HCN)。
学法题:就以上的解答思考,电离平衡常数(Ka)、水的离子积常数(Kw)、盐的水解常数(Kh)之间有什么关系,请写出他们的关系式____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com