
【题目】肉桂酸D(β-苯基丙烯酸)用于制备化妆品、香皂的香精,乜可制造局部麻醉剂、杀菌剂、止血药、植物生长促进剂、防腐剂、感光树脂等。下列是肉桂酸D的合成与应用的反应路线:
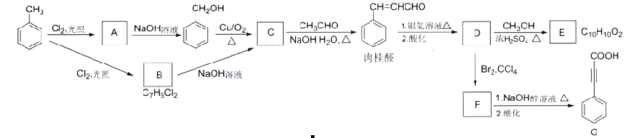
已知:![]()
(1)A的分子式是_______,A生成苯甲醇的反应类型是________。
(2)C的结构简式是_______,肉柱醛中的官能团名称是________。
(3)E是一种合成香精的定香剂,已知E为反式结构,则其结构简式为_______。
(4)在G中共直线的原子共有_______个,1molB转化为C最多消耗_______mol NaOH
(5)写出上图中F与NaOH醇溶液共热时的化学方程式________。
(6)P是E的同分异构体,写出符合下列条件的P的键线式_______。
①有两个相同的官能团;②能与新制氢氧化铜悬浊液作用产生砖红色沉淀;③含有苯环,核磁共振氢谱有三组面积之比为2︰2︰1的峰。
(7)以乙醇为原料,设计制备高分子化合物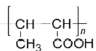 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
【答案】C7H7Cl 取代反应 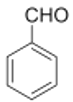 碳碳双键、醛基
碳碳双键、醛基 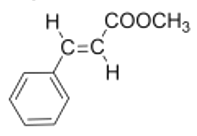 6 2
6 2 
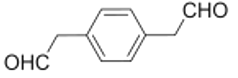
![]()
【解析】
甲苯经过在光照条件下与氯气发生取代反应生成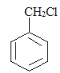 ,则A为氯甲苯,氯甲苯在氢氧化钠水溶液作用下发生取代反应生成
,则A为氯甲苯,氯甲苯在氢氧化钠水溶液作用下发生取代反应生成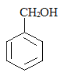 ,
, 铜作催化剂发生催化氧化生成
铜作催化剂发生催化氧化生成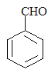 ,则C为
,则C为 ,根据已知给定条件可知,苯甲醛与乙醛在氢氧化钠水溶液加热条件下会生成肉桂醛,肉桂醛继续发生银镜反应,酸化后得到产物D,则D为
,根据已知给定条件可知,苯甲醛与乙醛在氢氧化钠水溶液加热条件下会生成肉桂醛,肉桂醛继续发生银镜反应,酸化后得到产物D,则D为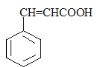 ,
, 继续发生酯化反应生成
继续发生酯化反应生成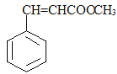 ,则推出E为:
,则推出E为: ,满足分子式为C10H10O2的条件;此外,结合C的结构简式采用逆合成分析法可知,甲苯在氯气光照条件下的副产物B的结构简式为:
,满足分子式为C10H10O2的条件;此外,结合C的结构简式采用逆合成分析法可知,甲苯在氯气光照条件下的副产物B的结构简式为: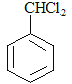 ;D(
;D( )与溴的四氯化碳溶液发生加成反应可得到
)与溴的四氯化碳溶液发生加成反应可得到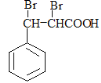 ,则F为
,则F为 ,最后发生消去反应生成G,据此分析作答。
,最后发生消去反应生成G,据此分析作答。
根据上述分析可知,
(1)A的结构简式为 ,则其分子式是C7H7Cl,A继续生成苯甲醇的反应类型是取代反应,
,则其分子式是C7H7Cl,A继续生成苯甲醇的反应类型是取代反应,
故答案为:C7H7Cl;取代反应;
(2)C为苯甲醛,其结构简式是 ,肉柱醛中的官能团名称是碳碳双键、醛基,
,肉柱醛中的官能团名称是碳碳双键、醛基,
故答案为: ;碳碳双键、醛基;
;碳碳双键、醛基;
(3)E为反式结构,则其结构简式为: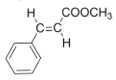 ,
,
故答案为: ;
;
(4)G为 ,碳碳三键的原子共直线,苯环上互为对位的原子共直线,则该分子中共直线的原子共有6个,1mol B
,碳碳三键的原子共直线,苯环上互为对位的原子共直线,则该分子中共直线的原子共有6个,1mol B 与2mol氢氧化钠水溶液加热条件下发生取代反应生成
与2mol氢氧化钠水溶液加热条件下发生取代反应生成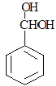 ,该分子不稳定,最终会转化为C(
,该分子不稳定,最终会转化为C( ),
),
故答案为:6;2;
(5)F为 ,溴原子与羧基均能与NaOH反应,因此该分子与NaOH醇溶液共热时的化学方程式为:
,溴原子与羧基均能与NaOH反应,因此该分子与NaOH醇溶液共热时的化学方程式为: ,
,
故答案为: ;
;
(6)E为 ,其分子式为:C10H10O2,有两个相同的官能团且能与新制氢氧化铜悬浊液作用产生砖红色沉淀,则说明含有两个醛基,含有苯环,核磁共振氢谱有三组面积之比为2︰2︰1的峰,则该分子处于苯环的对位,且分子为对称结构,其结构简式为:
,其分子式为:C10H10O2,有两个相同的官能团且能与新制氢氧化铜悬浊液作用产生砖红色沉淀,则说明含有两个醛基,含有苯环,核磁共振氢谱有三组面积之比为2︰2︰1的峰,则该分子处于苯环的对位,且分子为对称结构,其结构简式为: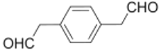 ,
,
故答案为: ;
;
(7)若要制备高分子化合物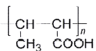 ,采用逆合成分析思想可知,需要制备CH3CH=CHCOOH,根据上述已知的合成路线可以先以乙醇为原料,催化氧化成乙醛以后,再根据给定信息,加长碳链增大不饱和度以后生成CH3CH=CHCHO,再氧化醛基到羧基,最后加聚制得目标高分子化合物,其具体合成路线:
,采用逆合成分析思想可知,需要制备CH3CH=CHCOOH,根据上述已知的合成路线可以先以乙醇为原料,催化氧化成乙醛以后,再根据给定信息,加长碳链增大不饱和度以后生成CH3CH=CHCHO,再氧化醛基到羧基,最后加聚制得目标高分子化合物,其具体合成路线:
![]() ,
,
故答案为:![]() 。
。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
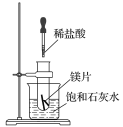
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法不正确的是
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
A. 同温度同浓度下,酸性由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数约为9×10-13
HF+OH-的平衡常数约为9×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:c(CO32-)+c(HCO3-)+ c(H2CO3)=0.2mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> >c (H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Li和石墨的复合材料以及纳米Fe2O3材料作电极的锂离子电池,在循环充放电过程中可实现对磁性的可逆调控(如图)。下列有关说法一定错误的是

A. 该电池的电解质溶液可以是硫酸溶液
B. 放电时,总反应式是6Li+Fe2O3=3Li2O+2Fe
C. 充电时,阳极的电极反应是2Fe+3Li2O-6e-= Fe2O3+6Li+
D. 充放电过程中,电池可在被磁铁不吸引和吸引之间循环调控
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积恒定的密闭容器中,加入2molCH4和2molH2O,发生如下反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),ΔH=akJ·mol1(a>0)。下列说法不正确的是( )
CO(g)+3H2(g),ΔH=akJ·mol1(a>0)。下列说法不正确的是( )
A.当容器内H2的物质的量n(H2)=3mol时,反应放出热量akJ
B.当CH4与H2的反应速率3v正(CH4)=v逆(H2)时,反应达到化学平衡状态
C.若保持温度不变,当容器内气压不再变化时,反应达到化学平衡状态
D.反应达到化学平衡状态后,再加入1molH2O,CH4的体积分数φ(CH4)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用平衡移动原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
C. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
D. 锌与稀硫酸反应,加入少量硫酸铜反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能由Ba(OH)2、NaOH、Na2CO3、KCl、K2SO4中的几种物质混合而成。取适量样品进行如下实验(假设各反应物都充分反应),根据实验现象和实验数据,下列说法不正确的是( )

A.沉淀甲中有1.97gBaCO3
B.固体混合物X中一定有Ba(OH)2、Na2CO3、K2SO4
C.根据上述实验现象无法确定固体混合物X中是否有NaOH
D.用铂丝蘸取溶液甲在酒精灯火焰上灼烧,通过蓝色钴玻璃观察焰色,即可判断X中有无KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)═2H2O(g) △H=484 kJ/mol
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
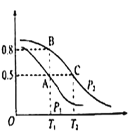
①A、B两点对应的压强大小关系是PA________PB(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ___________
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在P1压强、T1℃时,该反应的平衡常数K=_________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大”、“不变”或“减小”)
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ________ v逆(填>、< 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2A+3B![]() 2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是( )
2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是( )
A.用B表示的反应速率是0.75a mol/(L·min)
B.反应开始时,c(B)=3amol·L-1
C.反应2min后,c(A)=0.5amol·L-1
D.反应2min后,c(B)=1.5amol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com