
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)═2H2O(g) △H=484 kJ/mol
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
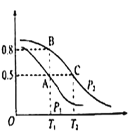
①A、B两点对应的压强大小关系是PA________PB(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ___________
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在P1压强、T1℃时,该反应的平衡常数K=_________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大”、“不变”或“减小”)
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ________ v逆(填>、< 或 =)。
【答案】2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) △H=-316kJ/mol < KA=KB>KC b 100 减小 >
【解析】
(1)已知:①CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol;
②2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,将2×①+②得到CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ/mol;
(2)①反应CO(g)+2H2(g)![]() CH3OH(g)是气体体积减小的反应,增大压强,平衡正向移动,反应物转化率增大,所以PA<PB;
CH3OH(g)是气体体积减小的反应,增大压强,平衡正向移动,反应物转化率增大,所以PA<PB;
②据图分析,随温度升高CO转化率降低,说明正反应放热,升温平衡逆向移动,平衡常数减小,所以KA=KB>KC;
③a.H2的消耗速率是CH3OH生成速率的2倍,二者表示的都是正反应速率,因此不能说明反应是否达到平衡状态,a错误;
b.CH3OH的体积分数不再改变说明正逆反应速率相等,反应达到平衡状态,b正确;
c.容器体积和气体质量始终不变,所以混合气体的密度始终不变,因此不能根据密度不变判断反应是否达到平衡状态,c错误;
d.CO和甲醇的化学计量数都为1,所以CO和CH3OH的物质的量之和始终保持不变,因此不能这一点判断反应是否达到平衡状态,d错误;
故合理选项是b;
(3)P1压强、T1°C时CO的转化率为0.5,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 0.1 0.2 0
改变浓度(mol/L) 0.050.1 0.05
平衡浓度(mol/L) 0.050.1 0.05
化学平衡常数K=![]() ;
;
若温度不变,再加入1.0molCO,平衡向正反应移动,重新达到平衡,氢气的转化率增大,但CO投入量大于平衡移动转化量,所以CO的转化率减小;
(4) T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol,此时反应的浓度商Qc=![]() <100,此时反应正向进行v正>v逆。
<100,此时反应正向进行v正>v逆。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
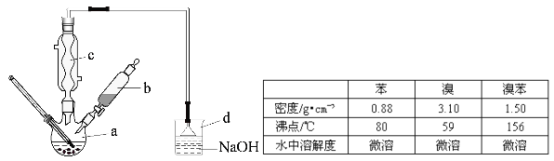
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸D(β-苯基丙烯酸)用于制备化妆品、香皂的香精,乜可制造局部麻醉剂、杀菌剂、止血药、植物生长促进剂、防腐剂、感光树脂等。下列是肉桂酸D的合成与应用的反应路线:
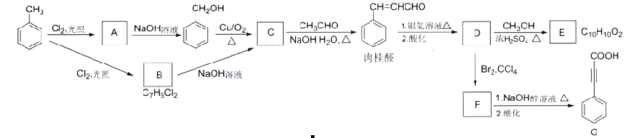
已知:![]()
(1)A的分子式是_______,A生成苯甲醇的反应类型是________。
(2)C的结构简式是_______,肉柱醛中的官能团名称是________。
(3)E是一种合成香精的定香剂,已知E为反式结构,则其结构简式为_______。
(4)在G中共直线的原子共有_______个,1molB转化为C最多消耗_______mol NaOH
(5)写出上图中F与NaOH醇溶液共热时的化学方程式________。
(6)P是E的同分异构体,写出符合下列条件的P的键线式_______。
①有两个相同的官能团;②能与新制氢氧化铜悬浊液作用产生砖红色沉淀;③含有苯环,核磁共振氢谱有三组面积之比为2︰2︰1的峰。
(7)以乙醇为原料,设计制备高分子化合物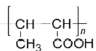 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是-种难溶的物质,可用CuSO4溶液和“另一种物质”在40C~50C时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是 ( )
A. CuH既可做氧化剂又可做还原剂
B. 另一种物质一定具有还原性
C. CuH跟HCl反应的化学方程式为:2CuH+2HCl=CuCl2+2H2↑+Cu
D. CuH在Cl2燃烧的化学方程式为:CuH+Cl2 ![]() CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的是
A. 2Na2O2+2H2O===4NaOH+O2↑ B. NH3+CO2+H2O===NH4HCO3
C. 2NaOH+Cl2===NaCl+NaClO+H2O D. NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:
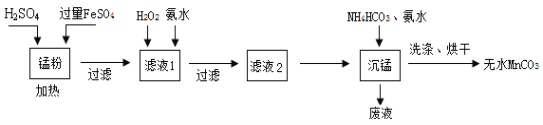
已知:①2H2SO4 + MnO2 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 10-13 | 10-17 | 10-38 |
根据上图流程及有关数据回答下列问题。
(1)锰粉酸溶时,过量FeSO4所起的作用为______________________。
(2)往滤液1中先加入H2O2的目的是氧化Fe2+,该反应的离子方程式为________________,后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1 mol·L-1,则需调节溶液的pH范围为_______________。
(3)沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释)___________,沉锰工序中判断沉淀已经洗涤干净的实验操作是________________________________。
(4)沉锰后废液中的主要成份为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中导电粒子的数目减少
B. 升高CH3COONa溶液的温度,溶液中![]() 增大
增大
C. 盐酸与氨水恰好完全反应,则溶液中c(H+)=c(OH-)
D. 向AgCl的饱和溶液中加入少量AgNO3溶液,则溶液中c(Ag+)·c(Cl-)保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式错误的是
A. 甲烷的电子式:![]()
B. 碳原子的L层电子轨道表示式:![]()
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. 碳-12原子:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com