
【题目】有 A、B、C、D 四种元素,它们的原子序数依次增大,由 B、C、D 形成的离子具有相同的电子层结构。C、D 单质都能跟水剧烈反应,1mol C 单质跟水反应产生 11.2L(标准状况下)B 气体单质,1mol D 单质跟水反应产生 11.2L(标准状况下)A 气体单质,此时 D 转化成具有氖原子核外电子层结构的离子。试填空:
(1)B 元素的名称为_____;D 在元素周期表中位置为_____。
(2)C 原子的结构示意图为_____,A 与 D 形成化合物的电子式为_____。
(3)写出 C、D 单质分别与水反应的化学方程式:C+H2O:_____; D+H2O:_____。
(4)B 与 D 形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为_____,该物质属于_____(填“离子化合物”或“共价化合物”)。
【答案】氧 第三周期第ⅠA族 ![]() Na+[:H]- 2F2+2H2O=4HF+O2 2Na+2H2O=2NaOH+H2↑ 离子键、共价键(或离子键、非极性键) 离子化合物
Na+[:H]- 2F2+2H2O=4HF+O2 2Na+2H2O=2NaOH+H2↑ 离子键、共价键(或离子键、非极性键) 离子化合物
【解析】
由“C、D 单质都能跟水剧烈反应,1mol C 单质跟水反应产生 11.2L(标准状况下)B 气体单质,1mol D 单质跟水反应产生 11.2L(标准状况下)A 气体单质”,可推出C为F,D为Na,A为H。再由“由 B、C、D 形成的离子具有相同的电子层结构”,可推出B为O。
(1)由以上推断可知,B 和D 分别 为O、Na,由此可知B的名称及D在周期表中的位置。
(2)C 为氟,A 与 D 形成化合物为NaH。
(3) C与水反应,生成HF和O2,D 单质与水反应,生成NaOH和H2。
(4)B 与 D 形成的两种化合物中,其中一种物质含有两种类型的化学键,则其为Na2O2。
(1)B 元素的名称为氧;D 为钠,其在元素周期表中位置为第三周期第ⅠA族。答案为:氧;第三周期第ⅠA族;
(2)C 为氟,其原子的结构示意图为![]() ,A 与 D 形成化合物为NaH,电子式为Na+[:H]-。答案为:
,A 与 D 形成化合物为NaH,电子式为Na+[:H]-。答案为:![]() ;Na+[:H]-;
;Na+[:H]-;
(3) C、D 单质分别与水反应的化学方程式:C+H2O:2F2+2H2O=4HF+O2; D+H2O:2Na+2H2O=2NaOH+H2↑。答案为:2F2+2H2O=4HF+O2;2Na+2H2O=2NaOH+H2↑;
(4)B 与 D 形成的两种化合物中,Na2O2中含有两种类型的化学键,分别为Na+与O22-间的离子键、O22-内两个O原子间的共价键(或离子键、非极性键),该物质含有离子键,属于离子化合物。答案为:离子键、共价键(或离子键、非极性键);离子化合物。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】化学可以变废为室,利用电解法处理烟道气中的NO,将其转化为NH4NO3的原理如下图所示,下列说法错误的是
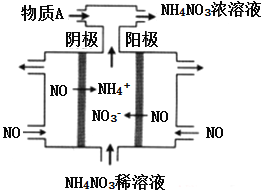
A. 该电解池的阳极反反为:NO-3e-+2H2O=NO3-+4H+
B. 该电解池的电极材料为多孔石墨,目的是提高NO的利用率和加快反应速率
C. 用NH4NO3的稀溶液代替水可以增强导电能力,有利于电解的顺利进行
D. 为使电解产物全部转化为NH4NO3,需补充物质A为HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是大气污染气体,可利用化学反应进行治理或转化。
(1)甲醇是重要的溶剂和燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①T℃时,向容积为2 L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,此时H2与CH3OH的体积分数之比为2∶5,该反应的平衡常数K=____;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),则平衡将____移动。(填“向正反应方向”、“不”或“向逆反应方向”)
②在一容积可变的密闭容器中充入一定物质的量的CO和H2,测得CO在不同温度下的平衡转化率与压强的关系如图所示。a、b、c三点平衡常数K(a)、K(b)、K(c)的大小关系是____。b、d两点的正反应速率vb(CO)____vd(CO)。

(2)沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

①a、b、c、d四点中表示平衡状态的是____;
②相同条件下,____型沥青混凝土催化效果更佳;
③e点转化率出现突变的原因可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
A.放出热量:Q1<Q2B.N2的转化率:II>I
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示。下列有关香天竺葵醇的说法错误的是
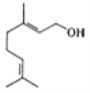
A.分子中含有两种官能团
B.该物质中的碳原子一定全部共面
C.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
D.香天竺葵醇能发生加聚反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀。根据上述实验事实,下列说法中,不正确的是
A.溶解度 MnS<PbS
B.MnS存在沉淀溶解平衡 MnS(s)![]() Mn2+(aq) + S2-(aq)
Mn2+(aq) + S2-(aq)
C.Cu2+转化为沉淀的原理为 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq)
D.沉淀转化能用于除去溶液中的某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中性、室温下,催化剂FeQ或FeCuQ催化![]() 解离产生的
解离产生的![]() 来降解浓度为
来降解浓度为![]() 的苯酚,降解率
的苯酚,降解率 随
随![]() 浓度、反应时间的关系如图所示
浓度、反应时间的关系如图所示![]() 保持其他条件相同
保持其他条件相同![]() 。
。
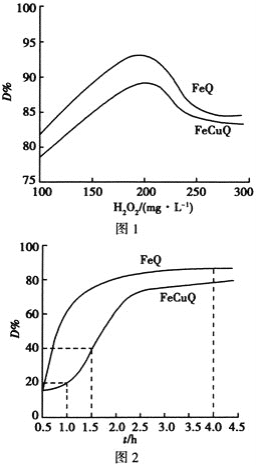
下列说法不正确的是 ![]()
![]()
A.在FeCuQ催化下,![]() 内,苯酚降解速率为
内,苯酚降解速率为![]() mol/(L·h)
mol/(L·h)
B.其他条件不变时,随![]() 浓度的增大,降解率
浓度的增大,降解率![]() 不一定增大
不一定增大
C.FeQ催化![]() 后,降解率
后,降解率![]() 不变,可能是反应达到了平衡状态
不变,可能是反应达到了平衡状态
D.随![]() 浓度的增大降解率
浓度的增大降解率![]() 减小的原因可能是过量
减小的原因可能是过量![]() 导致
导致![]() 浓度减小
浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常稳下,某绝热容器中盛有50mLc(H+)=10-3mol·L-1的HX溶液,向该容器中滴加c(OH-)=10-2mol·L-1的NaOH溶液,滴加过程中混合溶波的温度(T)与所加溶液体积(V)的关系如图所示。下列叙述不正确的是
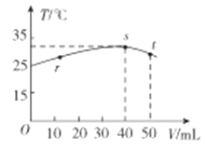
A.s点时:c(Na+)>c(X-)>c(OH-)>c(H+)
B.r→s的过程中,混合溶液中可能存在c(X-)=c(Na+)
C.pH=10的NaX溶液,用蒸馏水稀释10倍后,溶液的pH>9
D.已知某温度下CaX2的Ksp=5.3×10-9mol·L-3,在该温度下c(X-)=0.1mol·L-1的溶液中Ca2+可能的最高浓度是5.3×10-8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42—)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式:_____,指出使用空气的优点是:_______。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s) ΔH=-Q1 kJ/mol,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=______。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用____试剂可将其除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com