
【题目】在密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
A.放出热量:Q1<Q2B.N2的转化率:II>I
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II
【答案】AB
【解析】
N2和H2合成氨气的反应方程式为:N2+3H2![]() 2NH3,容器I的反应和容器II的反应主要是压强改变导致两个反应的平衡状态不一致,刚开始两个反应压强一致,随着反应进行,反应I压强减小,反应II压强不变,因此反应I到反应II压强增大,平衡向正反应方向移动。
2NH3,容器I的反应和容器II的反应主要是压强改变导致两个反应的平衡状态不一致,刚开始两个反应压强一致,随着反应进行,反应I压强减小,反应II压强不变,因此反应I到反应II压强增大,平衡向正反应方向移动。
A. 反应I到反应II平衡向正反应方向移动,所以达到平衡时反应放出的热量Q2>Q1,A正确;
B. 反应I到反应II压强增大,平衡向正反应方向移动,N2的转化率增大,B正确;
C. 化学平衡常数只与温度有关,与其它条件无关。由于I、II温度相同,所以平衡常数相等,C错误;
D.反应II相对于I来说就是增大压强。增大压强,化学平衡正向移动,因此达到平衡时氨气的体积分数:I<II,D错误;
答案选AB。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
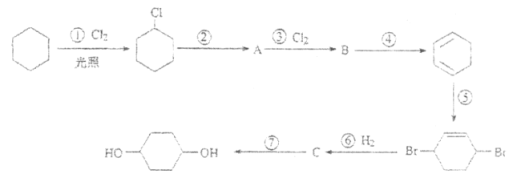
(1)写出反应④、⑦的化学方程式:
④__________________________________;
⑦__________________________________。
(2)上述七个反应中属于加成反应的有____________(填反应序号),A中所含有的官能团名称为____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为工业合成氨的流程图。有关说法错误的是

A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C. 步骤③、④、⑤均有利于提高原料的转化率
D. 产品液氨除可生产化肥外,还可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4溶于水并和水反应:NaBH4+2H2O![]() NaBO2+4H2↑,下列说法中正确的是(提示:NaBH4中H 元素为1价)
NaBO2+4H2↑,下列说法中正确的是(提示:NaBH4中H 元素为1价)
A. NaBH4中的H得到电子,转化为H2
B. NaBH4中的Na失去1个电子
C. 硼元素被氧化,氢元素被还原
D. 被氧化与被还原的元素质量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________;Y与过量浓硝酸反应后溶液中含有的盐的化学式为___________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___。
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
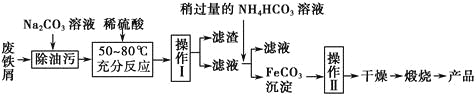
回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________;操作Ⅱ的方法为_____________________。
②请写出生成FeCO3沉淀的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C、D 四种元素,它们的原子序数依次增大,由 B、C、D 形成的离子具有相同的电子层结构。C、D 单质都能跟水剧烈反应,1mol C 单质跟水反应产生 11.2L(标准状况下)B 气体单质,1mol D 单质跟水反应产生 11.2L(标准状况下)A 气体单质,此时 D 转化成具有氖原子核外电子层结构的离子。试填空:
(1)B 元素的名称为_____;D 在元素周期表中位置为_____。
(2)C 原子的结构示意图为_____,A 与 D 形成化合物的电子式为_____。
(3)写出 C、D 单质分别与水反应的化学方程式:C+H2O:_____; D+H2O:_____。
(4)B 与 D 形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为_____,该物质属于_____(填“离子化合物”或“共价化合物”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.92g甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量。该反应的热化学方程式为__________。
(2)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。
已知:①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1,
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1,
结合上述热化学方程式,计算得出△H1= _______。
(3)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是___________反应(填“吸热”、“放热”)。
②在反应体系中加入催化剂,化学反应速率增大, E1、E2和ΔH的变化是:E1________,E2_______,ΔH _______(填“增大”、“减小”或“不变”)
③当反应达到平衡时,其他条件不变,升高温度,A的转化率______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com