
【题目】在中性、室温下,催化剂FeQ或FeCuQ催化![]() 解离产生的
解离产生的![]() 来降解浓度为
来降解浓度为![]() 的苯酚,降解率
的苯酚,降解率 随
随![]() 浓度、反应时间的关系如图所示
浓度、反应时间的关系如图所示![]() 保持其他条件相同
保持其他条件相同![]() 。
。
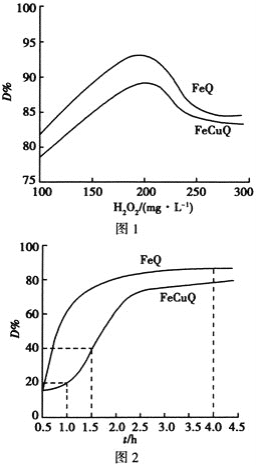
下列说法不正确的是 ![]()
![]()
A.在FeCuQ催化下,![]() 内,苯酚降解速率为
内,苯酚降解速率为![]() mol/(L·h)
mol/(L·h)
B.其他条件不变时,随![]() 浓度的增大,降解率
浓度的增大,降解率![]() 不一定增大
不一定增大
C.FeQ催化![]() 后,降解率
后,降解率![]() 不变,可能是反应达到了平衡状态
不变,可能是反应达到了平衡状态
D.随![]() 浓度的增大降解率
浓度的增大降解率![]() 减小的原因可能是过量
减小的原因可能是过量![]() 导致
导致![]() 浓度减小
浓度减小
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子![]() ”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图:
”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图:
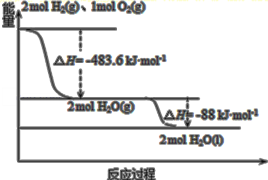
下列说法正确的是
A.2mol![]() 与1mol
与1mol![]() 所具有的总能量比
所具有的总能量比![]() 所具有的总能量低
所具有的总能量低
B.氢气的标准燃烧热为H=-285.8kJ/mol
C.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) H=-483.6kJ/mol
D.![]() 变成
变成![]() 的过程中,断键吸收的能量小于成键放出的能量
的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4溶于水并和水反应:NaBH4+2H2O![]() NaBO2+4H2↑,下列说法中正确的是(提示:NaBH4中H 元素为1价)
NaBO2+4H2↑,下列说法中正确的是(提示:NaBH4中H 元素为1价)
A. NaBH4中的H得到电子,转化为H2
B. NaBH4中的Na失去1个电子
C. 硼元素被氧化,氢元素被还原
D. 被氧化与被还原的元素质量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C、D 四种元素,它们的原子序数依次增大,由 B、C、D 形成的离子具有相同的电子层结构。C、D 单质都能跟水剧烈反应,1mol C 单质跟水反应产生 11.2L(标准状况下)B 气体单质,1mol D 单质跟水反应产生 11.2L(标准状况下)A 气体单质,此时 D 转化成具有氖原子核外电子层结构的离子。试填空:
(1)B 元素的名称为_____;D 在元素周期表中位置为_____。
(2)C 原子的结构示意图为_____,A 与 D 形成化合物的电子式为_____。
(3)写出 C、D 单质分别与水反应的化学方程式:C+H2O:_____; D+H2O:_____。
(4)B 与 D 形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为_____,该物质属于_____(填“离子化合物”或“共价化合物”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态铜原子的电子排布式为_____;价电子中成对电子数有_____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3 分子中的中心原子的杂化方式是_____。
②P 与 N 同主族,其最高价氧化物对应水化物的酸性:HNO3_____H3PO4(填“>”或“<”),
(3)某磷青铜晶胞结构如下图所示。

①则其化学式为_____。
②该晶体中距离 Cu 原子最近的 Sn 原子有_____个,这些 Sn 原子所呈现的构型为_____。
③若晶体密度为 8.82 g/cm3,最近的 Cu 原子核间距为_____pm(用含 NA 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.92g甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量。该反应的热化学方程式为__________。
(2)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。
已知:①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1,
②2C(s) + O2(g) = 2 CO(g); △H3=-221.0kJ·mol-1,
结合上述热化学方程式,计算得出△H1= _______。
(3)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是___________反应(填“吸热”、“放热”)。
②在反应体系中加入催化剂,化学反应速率增大, E1、E2和ΔH的变化是:E1________,E2_______,ΔH _______(填“增大”、“减小”或“不变”)
③当反应达到平衡时,其他条件不变,升高温度,A的转化率______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取0.lmolL-1HA溶液与0.1molL-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因______(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:______。
(4)混合液中:c(HA)+c(A-)=______molL-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序______(填字母)。
A. NH4HCO3B. NH4AC. NH4HSO4D. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是
A. 苯与液溴的反应:![]()
B. 2-丙醇的催化氧化反应:2CH3CH(OH)CH3 + O2 ![]() 2CH3CH2CHO + 2H2O
2CH3CH2CHO + 2H2O
C. 邻羟基苯甲酸与足量的NaHCO3溶液反应:![]() +2NaHCO3
+2NaHCO3![]()
![]() +2CO2↑+2H2O
+2CO2↑+2H2O
D. 实验室制取乙炔的反应:CaC2+2H2O → Ca(OH)2 + CH≡CH↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com