
【题目】(1)基态铜原子的电子排布式为_____;价电子中成对电子数有_____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3 分子中的中心原子的杂化方式是_____。
②P 与 N 同主族,其最高价氧化物对应水化物的酸性:HNO3_____H3PO4(填“>”或“<”),
(3)某磷青铜晶胞结构如下图所示。

①则其化学式为_____。
②该晶体中距离 Cu 原子最近的 Sn 原子有_____个,这些 Sn 原子所呈现的构型为_____。
③若晶体密度为 8.82 g/cm3,最近的 Cu 原子核间距为_____pm(用含 NA 的代数式表示)。
【答案】1s22s22p63s23p63d104s1(或[Ar]3d104s1) 10 sp3 > SnCu3P 4 平面正方形 
【解析】
(1)基态铜原子的电子排布式为1s22s22p63s23p63d104s1(或[Ar]3d104s1);价电子排布式为3d104s1,在11个价电子中,3d10都是成对电子。
(2)①PH3分子中的中心原子P形成3个σ键,还有1对孤对电子,由此可确定杂化方式。
②P 与 N 同主族,N在P的上方,非金属性N>P,由此可确定酸性关系。
(3)①利用均推法,该晶胞中,含有1个Sn原子,1个P原子,3个Cu原子,可确定其化学式。
②该晶体中距离 Cu 原子最近的 Sn 原子位于一个正方形面的4个顶点上。
③若晶体密度为 8.82 g/cm3,可建立体积与密度的关系式V=a3=![]() ,从而可求出a,再利用最近的 Cu 原子核间距=
,从而可求出a,再利用最近的 Cu 原子核间距=![]() ,可求出结果。
,可求出结果。
(1)基态铜原子的电子排布式为1s22s22p63s23p63d104s1(或[Ar]3d104s1);价电子排布式为3d104s1,在11个价电子中,3d10都是成对电子,所以成对电子数有10个。答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);10;
(2)①PH3分子中的中心原子P形成3个σ键,还有1对孤对电子,所以杂化轨道有4个,杂化方式是sp3。答案为:sp3;
②P 与 N 同主族,N在P的上方,非金属性N>P,所以其最高价氧化物对应水化物的酸性:HNO3>H3PO4。答案为:>;
(3)①利用均推法,该晶胞中,含有1个Sn原子,1个P原子,3个Cu原子,则其化学式为SnCu3P。答案为:SnCu3P;
②该晶体中距离 Cu 原子最近的 Sn 原子位于一个面的4个顶点上,因而有4个,这些 Sn 原子所呈现的构型为平面正方形。答案为:4;平面正方形;
③若晶体密度为 8.82 g/cm3,V=a3=![]() ,a=
,a=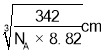 ,
,
最近的 Cu 原子核间距为![]() =
=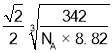 cm=
cm= pm。
pm。
答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
A.如图:常温下,0.1 mol ·L-1盐酸稀释时pH随加入水的体积变化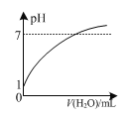
B.如图:铅蓄电池放电时,正极附近溶液的pH随时间的变化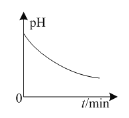
C.如图:不同压强下,可逆反应A(g)+B(g)![]() C(g)+D(s)中A的浓度随时间的变化
C(g)+D(s)中A的浓度随时间的变化
D.如图:镁条放入足量2 mol ·L-1盐酸中,生成氢气速率随时间的变化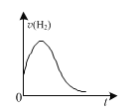
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水提溴的最主要方法之一是空气吹出法,工艺流程如下:

以下推断不合理的是
A.流程中循环利用的物质有SO2、Br2、Cl2,等多种
B.SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C.空气能吹出溴是利用溴易挥发的性质
D.没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示。下列有关香天竺葵醇的说法错误的是
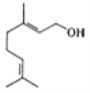
A.分子中含有两种官能团
B.该物质中的碳原子一定全部共面
C.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
D.香天竺葵醇能发生加聚反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述正确的是( )
A.H2Y的电离方程式为:H2Y![]() 2H++Y2-
2H++Y2-
B.HY-的水解方程式为:HY-+H2O![]() H3O++Y2-
H3O++Y2-
C.该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-)
D.该酸式盐溶液中离子浓度关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中性、室温下,催化剂FeQ或FeCuQ催化![]() 解离产生的
解离产生的![]() 来降解浓度为
来降解浓度为![]() 的苯酚,降解率
的苯酚,降解率 随
随![]() 浓度、反应时间的关系如图所示
浓度、反应时间的关系如图所示![]() 保持其他条件相同
保持其他条件相同![]() 。
。
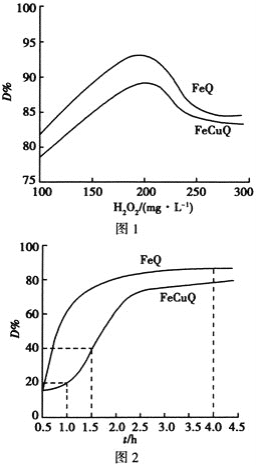
下列说法不正确的是 ![]()
![]()
A.在FeCuQ催化下,![]() 内,苯酚降解速率为
内,苯酚降解速率为![]() mol/(L·h)
mol/(L·h)
B.其他条件不变时,随![]() 浓度的增大,降解率
浓度的增大,降解率![]() 不一定增大
不一定增大
C.FeQ催化![]() 后,降解率
后,降解率![]() 不变,可能是反应达到了平衡状态
不变,可能是反应达到了平衡状态
D.随![]() 浓度的增大降解率
浓度的增大降解率![]() 减小的原因可能是过量
减小的原因可能是过量![]() 导致
导致![]() 浓度减小
浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定![]() 溶液先升温再降温过程中的pH,数据如下。实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验。④产生白色沉淀多。下列说法不正确的是
溶液先升温再降温过程中的pH,数据如下。实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验。④产生白色沉淀多。下列说法不正确的是![]()
![]()
时刻 | ① | ② | ③ | ④ |
温度 | 25 | 30 | 40 | 25 |
pH |
|
|
| 9.25 |
A.![]() 溶液中存在水解平衡:
溶液中存在水解平衡:![]()
B.④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的![]() 值相等
值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()

A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com