
【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请按要求回答下列问题。
(1)元素①的元素符号是_____________。
(2)元素②的单质电子式是______________。
(3)元素⑤的原子结构示意图是______________。
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)_______。
(5)这六种元素的最高价氧化物中,属于两性氧化物的元素是(填元素符号)_______。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_______________________;向上述反应后的溶液中再加入元素④的单质,发生反应的化学方程式为______________________。
【答案】C ![]()
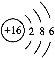 Cl Al 2Na+2H2O=2Na++2OH-+H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Cl Al 2Na+2H2O=2Na++2OH-+H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】
根据各元素在周期表中的位置可知,表中各元素分别为:①碳、②氮、③钠、④铝、⑤硫、⑥氯,结合元素原子的结构和性质以及元素周期律知识可对(1)到(6)小题进行解答。
(1)①位于第二周期IVA族的是6号元素碳,元素符号C,答案为:C
(2)元素②的单质是N2,N原子最外层有5个电子,需共用3对电子才能达到8电子饱和结构,所以N2的电子式为:![]() ,答案为:
,答案为:![]()
(3)元素⑤是硫,原子结构示意图为: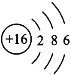 ,答案为:
,答案为: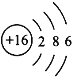
(4)6种元素中,属第三周期的是钠、铝、硫、氯。同周期元素的原子半径随原子序数的增大而减小,所以它们的原子半径依次减小。答案为:Cl
(5)这六种元素中,铝处于金属和非金属的交界处,其最高价氧化物Al2O3有两性;其他元素最高价氧化物中:CO2、N2O5、SO3、Cl2O7是酸性氧化物,Na2O是碱性氧化物。答案为:Al
(6)钠能与水反应产生氢气和氢氧化钠:2Na+2H2O=2NaOH+H2↑,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;铝与氢氧化钠溶液反应生成氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑


科目:高中化学 来源: 题型:
【题目】阿司匹林(结构如图)是一种历史悠久的解热镇痛药,诞生于1899年3月6日。用于治感冒、发热、头痛、牙痛、关节痛、风湿病,还能抑制血小板聚集,用于预防和治疗缺血性心脏病、心绞痛、心肺梗塞、脑血栓形成,应用于血管形成术及旁路移植术也有效。

(1)阿司匹林水溶液呈_____(填“酸性”、“碱性”、“中性”)。
(2)阿司匹林分子中虚线框内官能团的名称______(填名称)。
(3)阿司匹林必须密闭干燥存储,以防止在酸性条件下与水发生_______ 生成乙酸和水杨酸( ![]() )
)
A.水解反应 B.加成反应 C.酯化反应
(4)向阿司匹林水溶液中滴加饱和NaHCO3溶液,实验现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,对CO、NOx的综合利用是科学家研究的热点。回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) H2=-566kJ·mol-1
2NO(g)+O2(g)=2NO2(g) H3=-116.2kJ·mol-1
写出CO和NO2反应生成N2的热化学方程式:____。
(2)制备AlCl3的实际生产过程中,常加入足量的碳粉,反应后生成CO(g)。T℃时,向恒容密闭容器中加入3mol Al2O3(s)、8mol C(s)和3.3mol Cl2(g),发生反应。Cl2的浓度变化如图1所示;图2为20min后改变容器中条件,平衡体系的反应速率(v)随时间(t)的变化关系,且四个阶段都各改变一种不同的条件。
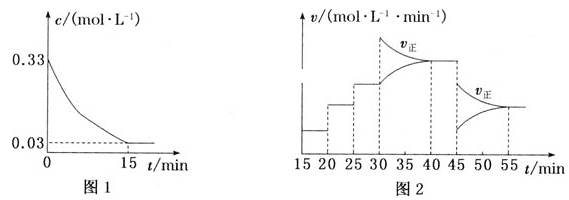
①容器中发生反应的化学方程式为___。
②0~15min内,该反应的平均速率v(CO)=___mol·L-1·min-1。
③T℃时,该反应的平衡常数K=___。
④15min时的平衡常数K(15)、44 min时的平衡常数K(44)与55min时的平衡常数K(55)的大小关系为____。
(3)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g)。一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___(填标号)。
4NO2(g)+O2(g)。一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___(填标号)。
A.容器中气体的密度不发生变化
B.NO2和O2的体积比保持不变
C.v正(NO2)=2v逆(N2O5)
D.气体的平均相对分子质量为43.2,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2.下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) △H1=+571.6kJmol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJmol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
A. 反应CH4(g)= C(s)+2 H2(g)的△H=+74.8kJmol﹣1 。
B. 电解水也可制取氢气和氧气,而且比方法①更方便,更节能。
C. 反应②每生成2g氢气,要吸收131.3kJ的热量,所以该反应没有应用价值。
D. 反应③中,若将各1mol的甲烷与水蒸气混合,要吸收206.1kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
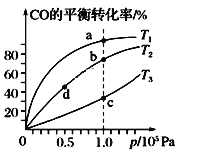
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c)、v(b)>v(d)
C.平衡常数:K(a)>K(c)、K(b)>K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
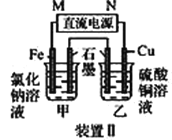
【题目】如图所示2套实验装置,分别回答下列问题。
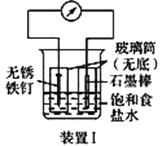
(1)装置Ⅰ为铁的吸氧腐蚀实验。一段时间后,铁被________(填“ 氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨附近的溶液变红,该电极反应为______________________________________。
(2)装置Ⅱ中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到铁片电极附近首先变红。电源的M端为________(填“正”或“负”)极,甲烧杯中铁电极的电极反应为____________,停止电解,乙中________电极质量增加。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如图装置合成正丁醛。
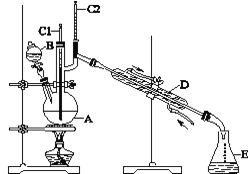
发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为_______。
(2)加入沸石的作用是_____________。若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是___________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com