
【题目】我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________。
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________。
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(4)反应Ⅲ中X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”)。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
【答案】MnO2 + e- + H2O = MnOOH + OH— MnO2+CuS +2H2SO4 = MnSO4 + CuSO4 + S + 2H2O Cu2++Zn = Cu+ Zn2+ bd > 5
【解析】
根据流程图:软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)加入硫酸酸浸,发生反应:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O、3MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S+6H2O、MnO2+CuS+2H2SO4=MnSO4+CuSO4+S+2H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O酸浸后的过滤液中含有Mn2+、Zn2+、Fe3+、Al3+,浸取渣为S和SiO2,加入适量的Zn和铁离子反应生成亚铁离子,把铜离子转化为铜单质,过滤除去Cu,向滤液加入MnO2氧化亚铁离子为铁离子,加入Zn(OH)2或MnCO3调节溶液pH,使Fe3+和Al3+转化为沉淀,Fe3+和Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,过滤除去,得到的滤液中含硫酸锰、硫酸锌,电解,阳极生成二氧化锰,阴极生成锌,同时得到硫酸,据此分析解答。
(1)电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,锌为负极发生氧化反应,正极为二氧化锰生成MnOOH的过程,结合电解质为碱溶液和电荷守恒、原子守恒,正极反应式为MnO2+H2O+e-=MnOOH+OH-,故答案为:MnO2+H2O+e-=MnOOH+OH-;
(2)滤渣1中除SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的S单质,反应的方程式为:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S+2H2O,故答案为: M nO2+CuS+2H2SO4=MnSO4+CuSO4+S+2H2O;
(3)反应Ⅱ中加入适量金属锌可以置换出Cu进而回收Cu,反应的离子方程式为:Zn+Cu2+=Zn2++Cu,故答案为:Zn+Cu2+=Zn2++Cu;
(4)反应Ⅲ中X的作用是调节溶液pH,使Fe3+和Al3+转化为沉淀,得到的含硫酸锰、硫酸锌的溶液,abcd均可调节pH,为不引入杂质可以选择Zn(OH)2或MnCO3,故答案为:bd;
(5)已知:H2S的K2=7.0×10-15,HS-的水解平衡常数=![]() =
=![]() >K2,说明HS-的水解平衡常数大于其电离平衡常数,故溶液显碱性,pH>7;故答案为:>;
>K2,说明HS-的水解平衡常数大于其电离平衡常数,故溶液显碱性,pH>7;故答案为:>;
(6)当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=a,H2S电离常数:K2=7.0×10-15,HS-浓度为1.0×10-4molL-1时,K2=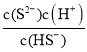 ,则7.0×10-15=
,则7.0×10-15=![]() ,则c(S2-)=7×10a-19molL-1,所以Ksp=c(Mn2+)c(S2-)=7×10a-19molL-1×0.020molL-1=1.4×10-15,解得a=5,故答案为:5。
,则c(S2-)=7×10a-19molL-1,所以Ksp=c(Mn2+)c(S2-)=7×10a-19molL-1×0.020molL-1=1.4×10-15,解得a=5,故答案为:5。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知 Be 的原子半径为 0.089nm):

(1)⑧号元素的在周期表中的位置是_______;上述元素处于同一主族的有_______。(用元素符号表示)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为 8 电子的稳定结构,写 出其电子式:_______(任写一种)。
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_______。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH 等)、便携式电源材料(LiCoO2 等)。根 据下列要求回答问题:
![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是_______
用作高温堆减速剂。下列说法正确的是_______
A.![]() 和
和![]() 互为同位素 B.
互为同位素 B.![]() 和
和![]() 属于同种核素
属于同种核素
C.![]() 和
和![]() 的化学性质不同 D.
的化学性质不同 D.![]() 和
和![]() 是同种物质
是同种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
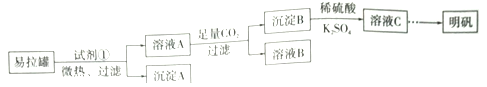
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。

(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列有关问题
(1)KW的数学表达式是KW =__________,温度升高KW的变化情况是______(选填“变大”“变小”或“不变”)。
(2)K通常表示化学平衡常数,K值越大表示该反应进行程度越________,对于反应2NO2(g) ![]() N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________。
N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________。
(3)Kα通常表示弱酸的电离平衡常数,Kα值越大表示该弱酸的酸性_______,对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Kα的变化情况是________(选填“变大”“变小”或“不变”)
(4)Ksp表示难溶物的溶度积常数,该常数越大表示难溶物在水中的__________。
(5)实验室可用NaOH溶液吸收NO2 ,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-) 和c(CH3COO-) 由大到小的顺序为_____________。(已知HNO2的电离常数Ka=7.1×104 mol/L,CH3COOH的电离常数为:Ka=1.7×105 mol/L),可使溶液A和溶液B的pH相等的方法是_____________。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学的叙述正确的是
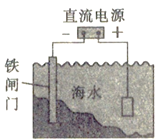
A. 镀锌的铁皮镀层破损后,铁更容易腐蚀
B. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
C. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率增大
D. 如图对海水中的铁闸门进行电化学防护的方法是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
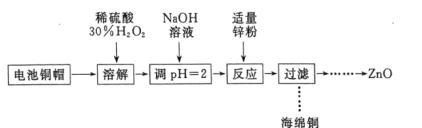
下列叙述错误的是( )
A. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2
C. 与加入锌粉反应的离子为Cu2+、H+
D. “过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是
A. 保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
B. 向少量氯化铁溶液中加入铁粉
向少量氯化铁溶液中加入铁粉
C.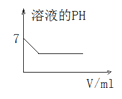 25℃时,向亚硫酸溶液中通入氯气
25℃时,向亚硫酸溶液中通入氯气
D.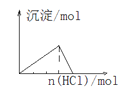 向NaAlO2溶液中通入HCl气体
向NaAlO2溶液中通入HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_____;
(2)液氨是富氢物质,是氢能的理想载体,利用![]() 实现储氢和输氢。下列说法正确的是________;
实现储氢和输氢。下列说法正确的是________;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________;
II.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。
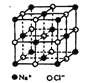
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则该Na+与跟它次近邻的C1-个数为______,该Na+与跟它次近邻的Cl—之间的距离为_____;
(2)已知在氯化钠晶体中Na+的半径为以a pm,Cl-的半径为b pm,它们在晶
体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为_____;(用含a、b的式子袁示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com