
【题目】现有下列短周期元素的数据(已知 Be 的原子半径为 0.089nm):

(1)⑧号元素的在周期表中的位置是_______;上述元素处于同一主族的有_______。(用元素符号表示)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为 8 电子的稳定结构,写 出其电子式:_______(任写一种)。
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_______。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH 等)、便携式电源材料(LiCoO2 等)。根 据下列要求回答问题:
![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是_______
用作高温堆减速剂。下列说法正确的是_______
A.![]() 和
和![]() 互为同位素 B.
互为同位素 B.![]() 和
和![]() 属于同种核素
属于同种核素
C.![]() 和
和![]() 的化学性质不同 D.
的化学性质不同 D.![]() 和
和![]() 是同种物质
是同种物质
【答案】第二周期第ⅢA族 Li和Na,N和P ![]() 2Na2O2+2H2O=4Na++4OH+ O2↑ AD
2Na2O2+2H2O=4Na++4OH+ O2↑ AD
【解析】
根据表中数据,①只有最低化合价-2,①为O;③和⑥只有最高正价+1,说明是第ⅠA族,且③半径较小,则③为Li,⑥为Na;半径②比⑥略小,且化合价为+2,则②为Mg;⑧化合价为+3,且半径略大于⑦,则⑧为B;根据化合价④⑦为第ⅤA族,且④半径较大,则④为P,⑦为N;⑤为第ⅦA,有+7价,则⑤为Cl。
(1)⑧号元素在周期表中的位置是第二周期第ⅢA族;上述元素处于同一主族的有Li和Na,N和P;
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为 8 电子的稳定结构,例如NCl3、PCl3、Cl2O等, Cl2O电子式为![]() 写出一种即可;
写出一种即可;
(3)元素O和Na能形成两种化合物,氧化钠在加热的情况下可以转化为过氧化钠,则过氧化钠比较稳定,过氧化钠与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH+ O2↑;
(4)根据同位素的定义A项正确;根据核素的定义,![]() 和
和![]() 属于两种核素,B项错误;同种元素组成的物质是同一种物质,化学性质相同 C项错误,D项正确;故正确选AD。
属于两种核素,B项错误;同种元素组成的物质是同一种物质,化学性质相同 C项错误,D项正确;故正确选AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
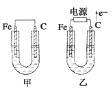
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的____________棒,乙池中的____________棒。
②乙池中阳极的电极反应式是___________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_________________ 。
②甲池中碳极上电极反应式是_____________________,
③若乙池转移0.02 mol e-后停止实验,溶液体积是200 mL,则溶液混合均匀后的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH > 0
B.已知2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热ΔH=-283 kJ
C.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2 溶液反应的反应热ΔH ==2×(-57.3) kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物与其氢化物能发生化合反应生成一种盐,D元素是地壳中含量最高的元素。回答下列问题:
(1)C元素的名称是____,在周期表中的位置是________。
(2)化合物BD2的结构式是_________,化合物EA的电子式是___________。
(3)A、D、E三种元素形成的化合物中含有的化学键类型有_________。
(4) D、E元素分别形成的简单离子半径大小关系是_____(用离子符号表示);B、C元素分别形成的简单气态氢化物的稳定性大小关系是___________(用化学式表示)。
(5)C元素的简单气态氢化物遇到蘸有浓硝酸的玻璃棒的现象是_________,其原因是_________(用化学方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种主族元素的离子![]() 、
、![]() 、
、![]() 、
、![]() (a、b、c、d 为元素的原子序数),它们具有相同的电子层结构,若 m>n,对下列叙述的判断正确的是( )
(a、b、c、d 为元素的原子序数),它们具有相同的电子层结构,若 m>n,对下列叙述的判断正确的是( )
①a-b=n-m ②元素的原子序数 a>b>c>d ③元素非金属性 Z>R ④最高价氧化物对应水化物碱性 X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度/(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/( L·min)
B. 升高温度,反应的平衡常数增大
C. 反应达到平衡时容器内的压强与初始时容器的压强之比为13:15
D. 平衡后移走2.0 mol PCl3和1.0 mol Cl2,相同条件下再达平衡时,c(PCl5)<0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:电导率越大导电能力越强。25℃时,用0.100 mol/L NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol/L的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示(注:混合后溶液体积等于混合前两溶液体积之和)。下列说法正确的是
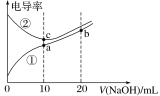
A. 曲线①代表滴定盐酸的曲线
B. a点溶液中:c(OH-)+c(CH3COO-)-c(H+)=0.1mol/L
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________。
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________。
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(4)反应Ⅲ中X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”)。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com