
【题目】下列各项反应对应的图像正确的是
A. 保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
B. 向少量氯化铁溶液中加入铁粉
向少量氯化铁溶液中加入铁粉
C.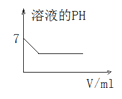 25℃时,向亚硫酸溶液中通入氯气
25℃时,向亚硫酸溶液中通入氯气
D.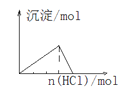 向NaAlO2溶液中通入HCl气体
向NaAlO2溶液中通入HCl气体
【答案】B
【解析】
A.BaSO4饱和溶液中,存在溶解平衡,BaSO4![]() Ba2++ SO42-,加硫酸钠,硫酸根离子浓度增大,溶解平衡逆向移动,BaSO4溶解度减小,故A错误;
Ba2++ SO42-,加硫酸钠,硫酸根离子浓度增大,溶解平衡逆向移动,BaSO4溶解度减小,故A错误;
B.向少量氯化铁溶液中加入铁粉,发生Fe+2FeCl3=3FeCl2,则Fe元素的质量增加,导致溶液的质量增加,而Cl元素的质量不变,所以Cl的质量分数减小,至反应结束不再变化,故B正确;
C.亚硫酸为弱酸,部分电离生成氢离子,溶液显酸性,pH<7,通入氯气,发生Cl2 + SO2 + 2H2O=H2SO4+2HCl,溶液的酸性增强,pH减小,直至不变,故C错误;
D.NaAlO2溶液中通入HCl气体,发生H++ AlO2-+H2O =Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,图中上升与下降段对应的横坐标长度之比应为1∶3,故D错误;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:电导率越大导电能力越强。25℃时,用0.100 mol/L NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol/L的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示(注:混合后溶液体积等于混合前两溶液体积之和)。下列说法正确的是
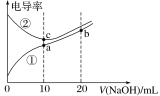
A. 曲线①代表滴定盐酸的曲线
B. a点溶液中:c(OH-)+c(CH3COO-)-c(H+)=0.1mol/L
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的粒子浓度关系正确的是
A. NH4Cl溶液中:c(Cl)=c(NH4+)>c(OH)=c(H+)
B. Na2SO4溶液中:c(Na+)+c(H+)=c(SO42)+c(OH)
C. NaHCO3溶液中:c(Na+)>c(HCO3)>c(CO32)>c(OH)
D. 浓度均为0.lmol/L的CH3COOH与CH3COONa溶液等体积混合后,pH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________。
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________。
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(4)反应Ⅲ中X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”)。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应。其中D 为纯净干燥的氯气与纯净干燥氨气反应的装置。
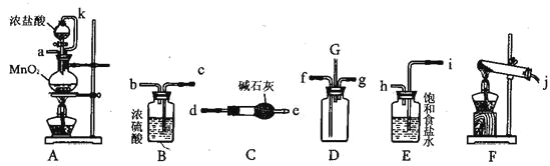
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是_____
(2)装置E 的作用是_____,橡胶管 k 的作用是_____
(3)装置F 中试管内发生反应的化学方程式 _____
(4)装置D 内出现浓厚的白烟并在容器内壁凝结,另一产物是空气的主要成分之一,写出该反应的化学方程式_____
(5)接入D 装置的两根导管左边较长、右边较短,目的是_____
(6)整套装置从左向右的连接顺序是(j)接______、______接(f) (g)接______ 、______接______ 、______接(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用香料乙酸橙花酯的结构简式如图所示,则关于该有机物叙述中正确的个数是( )

①分子式为C12H20O2 ②它的同分异构体中有芳香族化合物 ③能使酸性KMnO4溶液褪色 ④1mol该有机物在一定条件下能和3mol H2反应 ⑤密度比水小 ⑥1mol该有机物水解时能消耗1molNaOH⑦能在一定条件下生成高分子化合物
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学知识在物质制备领域的应用前景看好。

(1)从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:
①电解过程中阳极的电极反应式为______________________;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的___________(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗C1O-的物质的量为______mol;
(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。则丁为_________;电解一段时间,当产生0.1 mo1气体甲时,通过离子交换膜f的离子的质量为_____________g。
(3)用0.1032 mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 | 消耗NaOH溶液的体积/mL | 待测稀盐酸的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
根据表格计算c(HCl)=______________。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将__________ (填“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A _______ ,B________,C________,D________,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________ 。
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______________ 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)_______________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com