
����Ŀ��ij��ѧ��ȤС���������¸�װ�����ӳ�һ����װ�ã�̽�������백��֮��ķ�Ӧ������D Ϊ��������������봿�����ﰱ����Ӧ��װ�á�
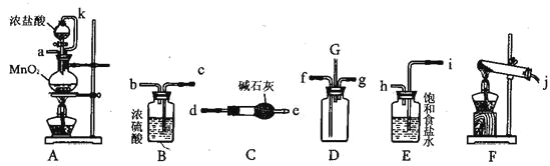
��ش��������⣺
(1)���Ӻ�װ�ú�����е�һ��ʵ�������_____
(2)װ��E ��������_____���� k ��������_____
(3)װ��F ���Թ��ڷ�����Ӧ�Ļ�ѧ����ʽ _____
(4)װ��D �ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�����ǿ�������Ҫ�ɷ�֮һ��д���÷�Ӧ�Ļ�ѧ����ʽ_____
(5)����D װ�õ�����������߽ϳ����ұ߽϶̣�Ŀ����_____
(6)����װ�ô������ҵ�����˳����(j)��______��______��(f) (g)��______ ��______��______ ��______��(a)
���𰸡����װ�������� ��ȥ�����е��Ȼ������� ƽ����ѹ����֤Ũ����˳������ 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+ 2H2O 8NH3+3Cl2= 6NH4Cl+N2 ʹ������������ֽӴ� d e b c h i
CaCl2+2NH3��+ 2H2O 8NH3+3Cl2= 6NH4Cl+N2 ʹ������������ֽӴ� d e b c h i
��������
AΪ�Ʊ������ķ���װ�ã�B����������װ�ã�C���ﰱ����װ�ã�D�����백���ķ���װ�ã�EΪ��ȥ�����е��Ȼ���ij���װ�ã�FΪ�Ʊ������ķ���װ�á�
��1�����Ӻ�װ�ú�����е�һ��ʵ������Ǽ��װ�õ������ԣ��ʴ�Ϊ�����װ�������ԣ�
��2����ΪŨ�����лӷ��ԣ������Ʊ����������л�����������Ȼ��⣬Ӧ�ñ��͵�ʳ��ˮ���г��ӣ���װ��E �������dz�ȥ�����е��Ȼ������壻�� k ������ƿ�ͷ�Һ©������ɺ�ѹװ�ã�������ƽ����ѹ����֤Ũ����˳�����£��ʴ�Ϊ����ȥ�����е��Ȼ������壻ƽ����ѹ����֤Ũ����˳�����£�
��3��FΪ�Ʊ������ķ���װ�ã����еĻ�ѧ��Ӧ����ʽΪ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+ 2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2
CaCl2+2NH3��+ 2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+ 2H2O��
CaCl2+2NH3��+ 2H2O��
��4�������������ʾ��֪�������Ͱ�����Ӧ�IJ���Ϊ�Ȼ�狀͵������䷴Ӧ�Ļ�ѧ����ʽΪ8NH3+3Cl2= 6NH4Cl+N2���ʴ�Ϊ��8NH3+3Cl2= 6NH4Cl+N2��
��5�������ܶȽϴӶ̹ܽ��룬�������ܶȽ�С���ӳ��ܽ��룬���������ܹ�ʹ�������е������Ͼ��ȣ��Ӵ�����֣��ʴ�Ϊ��ʹ������������ֽӴ���
��6���ɷ�����֪������װ�ô������ҵ�����˳����(j)��d��e��(f) (g)��b��c��h��i��(a)���ʴ�Ϊ��d��e��b��c��h��i��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ϻϳ�CH3OH��ԭ��Ϊ��2H2(g)+CO![]() CH3OH(g)��һ���¶��£���1L�����ܱ������г���H2��CO����Ӧ��ƽ��ʱCH3OH����������뷴Ӧ��Ͷ��֮��(n(H2)/n(CO))�Ĺ�ϵ��ͼ��ʾ������˵���������
CH3OH(g)��һ���¶��£���1L�����ܱ������г���H2��CO����Ӧ��ƽ��ʱCH3OH����������뷴Ӧ��Ͷ��֮��(n(H2)/n(CO))�Ĺ�ϵ��ͼ��ʾ������˵���������
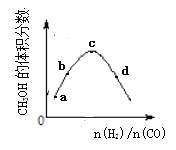
A. ��ͬ�����£��ﵽƽ��ʱ���������ܶ��뷴Ӧǰ��ͬ
B. a��b��c��d�ĵ���,c��CO��ת�������
C. ��Ͷ��ʱn(CO)���䣬a��b��c��d�ĵ���d��CH3OH�����ʵ������
D. ͼ���� c�㵽d�㣬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��п��ϡ����ķ�Ӧ����(��v(H2)��ʾ)����Ӧ���Һ�м��������������ʣ������ж���ȷ����
A. ����NH4HSO4���壬v(H2)���� B. ����KNO3���壬v(H2)����
C. ����CH3COONa���壬v(H2)��С D. �μ�CuSO4��Һ��v(H2)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص绯ѧ��������ȷ����
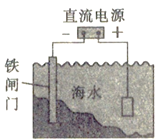
A. ��п����Ƥ�Ʋ��������������ʴ
B. ��ͭƬ�������Ȼ�����Һ�У���ͭƬ�������һ����
C. ��п������ʢ��������Թ��У����뼸���Ȼ�ͭ��Һ���������ݵ���������
D. ��ͼ�Ժ�ˮ�е���բ�Ž��е绯ѧ�����ķ�������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��ǿ�ᣬŨ�ȳ���40%ʱ�ᷢ���ֽ⣬��Ӧ�ɱ�ʾΪ��aHClO3�TbO2��+cCl2��+dHClO4+eH2O����ʪ��ĵ��۵⻯����ֽ�����������ʱ����ֽ�ȱ�������ɫ������˵������ȷ����
A.�ɷ�Ӧ���ƶ������ԣ�HClO4��HClO3
B.�����ĵ��۵⻯����ֽ��ɫ����Ϊ���ܷ����ˣ�5Cl2+I2+6H2O�T12H++10Cl-+2IO3-
C.������ֽ����û�����壬1 mol�����������Ϊ47.6 g����Ӧ����ʽ�ɱ�ʾΪ26HClO3 �T15O2��+8Cl2��+10HClO4+8H2O
D.����ѧ������a=8��b=3����÷�Ӧת�Ƶ�����Ϊ20e-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��Ӧ��Ӧ��ͼ����ȷ����
A. �����¶Ȳ��䣬��BaSO4������Һ�м��������ƹ���
�����¶Ȳ��䣬��BaSO4������Һ�м��������ƹ���
B. �������Ȼ�����Һ�м�������
�������Ȼ�����Һ�м�������
C.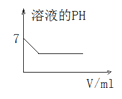 25��ʱ������������Һ��ͨ������
25��ʱ������������Һ��ͨ������
D.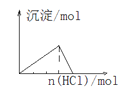 ��NaAlO2��Һ��ͨ��HCl����
��NaAlO2��Һ��ͨ��HCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA Ϊ�����ӵ�������ֵ������˵������ȷ����( )
A.0.l mol Cl2�����������۳�ַ�Ӧת�Ƶĵ�����Ϊ 0.2 NA
B.1.0 mol CH4 ��Cl2 �ڹ����·�Ӧ���ɵ� CH3Cl ������Ϊ 1.0 NA
C.��״���£�11.2 L�������ϩ(C2H4)������к���ԭ����ĿΪ2 NA
D.0.1mol Cl2 ͨ��ˮ�У�HClO��Cl-��ClO-������֮��С�� 0.2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ˮ��Һ�д��ڸ�����Ϊ������롢ˮ�⡢�����ܽ⣬����ѧ֪ʶ�ش��������⣺
��1��t��ʱ����ˮ��c(H+)��1��10-6 mol��L-1�� ���¶��£�pH��10��Ba(OH)2��Һ�����ʵ���Ũ��Ϊ_________ mol��L-1��
��2��25��ʱ���� a mol��L-1 �Ĵ���� b mol��L-1 ������������Һ�������Ϻ���Һ��pH=7������Һ��c(CH3COO-)+c(CH3COOH)=__________ mol��L-1��a_______ b�����������������=������
��3����ҵ�ϲ�ȡ�ð�ˮ��ȥSO2����֪25 �棬NH3 H2O��Kb=1.8��10��5��H2SO3�� Ka1=1.3 �� 10һ2��Ka2=6��2 �� 10һ8������ˮ��Ũ��Ϊ2.0 mo1/ L����Һ�е�c(OH��)=_____ mo1/ L����SO2ͨ��ð�ˮ�У���c(OH��)����2.0 �� 10һ6mo1/ Lʱ����Һ�е�![]() =_____________��
=_____________��
��4����AgCl�ֱ���룺��5 mLˮ ��10 mL 0.1 mol��L-1 MgCl2��Һ��40 mL 0.3mol��L-1 ������Һ���ܽ�����Һ���� ��20 mL 0.5mol��L-1 NaCl��Һ ������Һ��Ag+��Ũ�ȷֱ�Ϊa��b�� c��d�������ɴ�С������˳����____________������ĸ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ����ͭ��֮�硱�������˴��۶���ë������ɢ���̵����������ͭ�����о���ͭ������Cu��Sn�ȣ��ڳ�ʪ�����з����ĸ�ʴ�������ﱣ����������Ҫ���塣��ͼΪ��ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ������˵������ȷ����( )

A. ��ͭ�������绯ѧ��ʴ��ͼ��c������
B. ��ʪ������Cl-Ũ�ȴ������ڶ��״�������
C. ������0.2 mol Cu2(OH)3Cl�������ĵ�O2���Ϊ4.48L
D. �����е�Cl��������������Ӧ�IJ�����������a�����ӷ���ʽΪ2Cu2++3OH+Cl===Cu2 (OH)3Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com