
| A.原子序数为7 | B.周期表中第一电离能最小 |
| C.周期表中原子半径最大 | D.周期表中电负性最大 |


科目:高中化学 来源:不详 题型:单选题
| A.原子半径:W>X >Y>Z |
| B.单质与盐酸反应速率:Y>W |
| C.X最低价氢化物的稳定性强于Z最低价氢化物 |
| D.W的氢氧化物的碱性强于Y的氢氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+1 | B.+2 | C.+3 | D.+4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
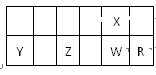
| A.X、W形成的某种化合物是造成酸雨的主要物质之一 |
| B.气态氢化物的热稳定性:HmX>HnR>HmW |
| C.Z、W、R分别与X形成的化合物的水化物都是强酸 |
| D.X、Y、R 形成的简单离子中,半径大小为:R—>X2—>Y2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验方案 (只填写选用试剂序号) | 实验现象 | 结论 | |
| ⑴ | | 一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 | 金属性: |
| ⑵ | | | 非金属性:Cl>Br |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同周期元素中,ⅦA族元素的原子半径最大 |
| B.ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C.在元素周期表中最容易找到半导体材料的合理位置是过渡元素区 |
| D.元素周期表中从ⅢB到ⅡB这10个纵行的元素都是金属元素. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从左到右,原子半径逐渐减小 |
| B.从左到右,元素单质的氧化性减弱,还原性增强 |
| C.从左到右,元素最高正将数从+1递增到+7,负价由—4递变到—1(O、F除外) |
| D.从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com