
【题目】25℃时,有下列四种溶液:①0.1mol/L的CH3COOH溶液;②pH=13的NaOH溶液;③0.05mol/L的H2SO4溶液;④0.1mol/L的Na2CO3溶液。则下列有关说法中正确的是( )
A.溶液④显碱性,用离子方程式解释其原因可表示成:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.在上述四种溶液中,pH由大到小的顺序为:②④①③
C.将该温度下amL的溶液②与bmL的溶液③混合,所得混合溶液的pH=7,则a:b=1:2
D.若将溶液④和Al2(SO4)3溶液混合,一定可观察到有白色胶状沉淀和无色气体生成
【答案】B
【解析】
A.④Na2CO3溶液显碱性,是由于该盐是强酸弱碱盐,在溶液中CO32-发生水解反应,消耗水电离产生的H+,水解产生的HCO3-会进一步发生水解作用,水解反应逐步进行,所以用离子方程式解释其原因可表示成:CO32-+H2O![]() HCO3-+OH-,错误;
HCO3-+OH-,错误;
B.溶液的酸性越强,pH越小;溶液的碱性越强,pH就越大。醋酸是弱酸,主要以酸分子存在,电离产生的H+小于酸分子的浓度;硫酸是二元强酸,溶液中c(H+)等于酸浓度的2倍;NaOH是强碱,其电离产生的氢氧根离子的浓度远大于盐Na2CO3水解产生的氢氧根离子的浓度,所以在上述四种溶液中,pH由大到小的顺序为:②④①③,正确;
C.由于NaOH溶液中c(OH-)和硫酸溶液中c(H+)相等,若二者混合,所得混合溶液的pH=7,则,则溶液显酸性,二者的体积比a:b=1:1,错误;
D.Na2CO3溶液呈碱性,氢氧化铝是两性氧化物,若碳酸钠溶液不足量,发生反应:3Na2CO3+ Al2(SO4)3+3H2O=3Na2SO4+3CO2↑+2Al(OH)3↓,当Na2CO3溶液呈过量不可能产生二氧化碳气体,错误。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___,溶液中c(Na+)___c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈___,醋酸体积___氢氧化钠溶液体积。
(4)常温下,Ksp(PbI2)=8.5×10-9。取适量黄色PbI2粉末溶于水中,充分揽拌后得到浊液,过滤。在滤液中加入少量KI,测得c(I-)=1.0×10-2mol·L-1。则c(Pb2+)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,
时,![]() 橘红色
橘红色![]() 在水溶液中沉淀溶解平衡曲线如图所示。又知AgCl的
在水溶液中沉淀溶解平衡曲线如图所示。又知AgCl的![]() 下列说法正确的是
下列说法正确的是

A.将![]() 溶液滴加到KCl溶液中,反应的活化能几乎为零
溶液滴加到KCl溶液中,反应的活化能几乎为零
B.![]() 时,
时,![]() 的
的![]()
C.饱和![]() 溶液中,加入水能使溶液由X点变为Y点
溶液中,加入水能使溶液由X点变为Y点
D.![]() 时,AgCl比
时,AgCl比![]() 的溶解度大
的溶解度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol LCaCl2溶液中滴加0.1mol L 的Na2CO3溶液,滴加过程中溶液中-lgc(Ca2+)与Na2CO3 溶液体积(V)的关系如图所示,下列有关说法正确的是

A. Z 点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为y点
C. 若用等浓度的Na2SO4 溶液代替Na2CO3 溶液,则图像在x点后的变化如虚线部分所示
D. Ksp(CaCO3])=5 x 10-10mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于放热反应的是
A.2Na +2H2O = 2NaOH + H2↑
B.CaCO3![]() CaO +CO2↑
CaO +CO2↑
C.C + H2O![]() CO + H2
CO + H2
D.2NH4Cl + Ba(OH)2·8H2O = BaCl2+2NH3↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有___________、__________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | —— | —— | —— |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有___________;但溶液的pH不能超过8,其理由是_____________________。
(4)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为![]() 的
的![]() 溶液和HCN溶液的pH分别为m和
溶液和HCN溶液的pH分别为m和![]() 下列叙述中不正确的是
下列叙述中不正确的是
A.HCN溶液和NaOH溶液不等体积混合后一定存在![]()
B.等温下,等浓度的![]() 溶液和NaCN溶液的pH,后者大
溶液和NaCN溶液的pH,后者大
C.常温下,pH相同的![]() 溶液和HCN溶液分别加水稀释相同的倍数时,前者pH的变化小
溶液和HCN溶液分别加水稀释相同的倍数时,前者pH的变化小
D.溶液中由水电离出的![]() ,前者是后者的
,前者是后者的![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 溶液滴定
溶液滴定![]() 溶液,曲线如图所示。下列说法错误的是
溶液,曲线如图所示。下列说法错误的是
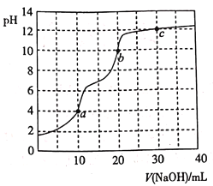
A.滴定终点a可选择甲基橙作指示剂
B.c点溶液中![]()
C.b点溶液中![]()
D.a、b、c三点中水的电离程度最大的是c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 能发生反应
能发生反应![]() 未配平
未配平![]() :
:![]() 。该反应的速率v随
。该反应的速率v随![]() 的增大而增大,如图是v
的增大而增大,如图是v ![]() 图。下列说法中不正确的是
图。下列说法中不正确的是
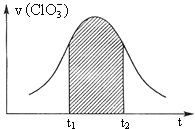
A.开始时反应速率增大可能是由![]() 增大所致
增大所致
B.纵坐标为![]() 的
的![]() 曲线与图曲线完全重合
曲线与图曲线完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.阴影部分面积可以表示![]() 时间内
时间内![]() 增加
增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com