
【题目】在![]() 时,
时,![]() 橘红色
橘红色![]() 在水溶液中沉淀溶解平衡曲线如图所示。又知AgCl的
在水溶液中沉淀溶解平衡曲线如图所示。又知AgCl的![]() 下列说法正确的是
下列说法正确的是

A.将![]() 溶液滴加到KCl溶液中,反应的活化能几乎为零
溶液滴加到KCl溶液中,反应的活化能几乎为零
B.![]() 时,
时,![]() 的
的![]()
C.饱和![]() 溶液中,加入水能使溶液由X点变为Y点
溶液中,加入水能使溶液由X点变为Y点
D.![]() 时,AgCl比
时,AgCl比![]() 的溶解度大
的溶解度大
科目:高中化学 来源: 题型:
【题目】25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,下列判断不正确的是( )
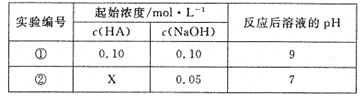
A.X>0.05
B.将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大
C.实验①所得溶液c(A-)+c(HA)=0.10mol·L-1
D.实验②所得溶液: c(Na+)+c(OH-)= c(A-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)25℃时,pH=5的CH3COOH溶液中.加入少量NaOH固体,则溶液中![]() _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
(2)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
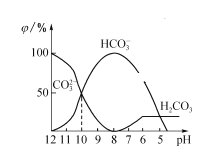
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为___________________________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh值为_________。
HCO3-+OH-的平衡常数Kh值为_________。
(3)生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
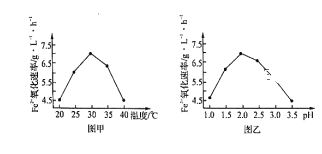
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是___________。
②由图甲和图乙判断使用硫杆菌的最佳条件为____________。在最佳条件下,该反应的加热
方式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.

1)写出该反应的方程式:__________________
2)计算该温度下该反应的平衡常数:____________
3)已知:K(300℃)<K(350℃),该反应是__________热反应.
4)0~4分钟时,B的平均反应速率为:____________
5)到达平衡时A的转化率为:____________
6)恒容条件下,下列措施中能使n(A)/n(C)降低的有____________.
A.充入氦气 B.使用催化剂
C.再充入2.4molA和1.6molB D.降低温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
①标准状况下,4.48L NO 和2.24L O2 充分混合后所得混合物分子数为0.2NA
②含13g甲醛(HCHO)和17g乙酸(CH3COOH)的液体混合物中,氧原子数目为NA
③0.1 mol H2和 0.1 mol I2于密闭容器中充分反应后,其分子总数为 0.2NA
④1mol Na2O 和Na2O2混合物中含有的阴、阳离子总数是3NA
⑤常温常压下,30g的C2H6含有的共价键数为6NA
⑥标准状况下,22.4L HF中所含F原子数目为NA
⑦在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
A.②③④⑦B.①④⑤⑥C.①②③⑤⑥D.①②④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验及其分析叙述正确的是( )
A.向2.0mL浓度均为0.lmolL-l的KC1、KI混合溶液中滴加1~2滴0.0lmol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2,铜粉仍不溶解
C.向AlC13溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失
D.将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2,也无沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,不溶于水和乙醚(易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,其制备装置如下(已知Cr3+水溶液颜色为绿色,Cr2+水溶液颜色为蓝色):

(1)装置甲中连通管a的作用是________________________。
(2)向三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液:关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速;当观察到三颈烧瓶中溶液颜色__________________时,打开k2关闭k1,当观察到装置乙中出现大量红棕色晶体时,关闭分液漏斗的旋塞。
(3)装置乙中反应的离子方程式为__________________________________。
(4)将装置乙中混合物快速过滤、洗涤和干燥,称量得到a g [Cr(CH3COO)2]2·2H2O。洗涤时依次用去氧的冷蒸馏水、无水乙醇、乙醚洗涤。其中乙醇洗涤的目的是___________。
(5)若实验所取用的CrCl3溶液中含溶质b g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376) 的产率是________________。
(6)该实验装置有一个明显的缺陷,解决此缺陷的措施为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH=____________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法:反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:
S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:
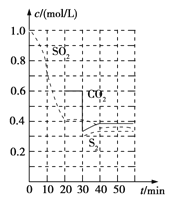
①0~20 min反应速率表示为v(SO2)=____________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是____________;
③平衡常数的表达式K=____________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是____________(填序号)。
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.水电离出c(H+)=1×10-8mol/L
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com