
【题目】I.食醋常用于食品调味,其主要成分为醋酸。请回答:
(1)写出醋酸的电离方程式________________
(2)0.1mol/L醋酸溶液中加入少量盐酸,电离平衡向___反应方向移动(填“正”或“逆”)。
(3)在0.1mol/L醋酸溶液中加入少量醋酸钠晶体,晶体溶解后,醋酸溶液的pH____(选填“增大”“减小”或“不变”)。
(4)0.1mol/L醋酸溶液的pH____(选填“>”“=”或“<”)0.1mol/L盐酸溶液的pH。
(5)在0.1mol/L醋酸溶液中加入等体积等浓度的氢氧化钠溶液,反应后溶液显____性。
II.某同学想用实验确定CH3COOH是弱电解质。其方案是:
①称取一定质量的CH3COOH配制0.1molL-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HCOOH是弱电解质。
(1)方案的第①步中,要用到的玻璃定量仪器是______。
(2)该方案中,说明CH3COOH是弱电解质的理由是测得溶液的pH______1(选填>、<、=)。
(3)结合你所学的知识,试再提出一个简单易操作的可行方案证明CH3COOH是弱电解质(药品可任取)。_______________
【答案】CH3COOH![]() CH3COO-+H+ 逆 增大 > 碱 100mL的容量瓶 > 用量筒量取0.1mol/L的盐酸和醋酸溶液各2mL,测量其pH值,然后分别加水稀释10倍,再次测量二者的pH值,比较二者稀释前后的pH的变化值△pH,可以看出
CH3COO-+H+ 逆 增大 > 碱 100mL的容量瓶 > 用量筒量取0.1mol/L的盐酸和醋酸溶液各2mL,测量其pH值,然后分别加水稀释10倍,再次测量二者的pH值,比较二者稀释前后的pH的变化值△pH,可以看出![]() ,故可知醋酸为弱电解质
,故可知醋酸为弱电解质
【解析】
I.(1)醋酸为弱电解质,电离时部分电离,其电离方程式为:CH3COOH![]() CH3COO-+H+,答案为:CH3COOH
CH3COO-+H+,答案为:CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。
(2)0.1mol/L醋酸溶液中加入少量盐酸,盐酸是强电解质,在溶液中完全电离,即HCl=H++Cl-,溶液中c(H+)浓度增大,抑制了醋酸的电离,使CH3COOH![]() CH3COO-+H+的电离平衡向左移动,即向逆反应方向移动。故答案为:逆。
CH3COO-+H+的电离平衡向左移动,即向逆反应方向移动。故答案为:逆。
(3)醋酸钠是强电解质,溶解后完全电离:CH3COONa![]() CH3COO- +Na+,电离出的CH3COO-抑制了醋酸的电离,使CH3COOH
CH3COO- +Na+,电离出的CH3COO-抑制了醋酸的电离,使CH3COOH![]() CH3COO-+H+的电离平衡向左移动,c(H+)减小,pH增大,故答案为:增大。
CH3COO-+H+的电离平衡向左移动,c(H+)减小,pH增大,故答案为:增大。
(4)醋酸为弱电解质,盐酸为强电解质。浓度均为0.1mol/L醋酸和盐酸中,![]() ,故0.1mol/L醋酸溶液的pH大于0.1mol/L盐酸溶液的pH。故答案为:>。
,故0.1mol/L醋酸溶液的pH大于0.1mol/L盐酸溶液的pH。故答案为:>。
(5)等物质的量醋酸和氢氧化钠发生反应:CH3COOH+NaOH=CH3COONa+H2O,生成的CH3COONa是强碱弱酸盐,在溶液中完全电离,而CH3COO-在水溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,使得溶液中
CH3COOH+OH-,使得溶液中![]() ,故溶液显碱性。答案为:碱。
,故溶液显碱性。答案为:碱。
II.(1)称取一定质量的CH3COOH配制0.1molL-1的溶液100mL,需要用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管和100mL容量瓶,其中定量仪器是100mL的容量瓶。故答案为: 100mL的容量瓶。
(2)0.1molL-1的CH3COOH溶液,若是强电解质,则完全电离,其中的c(H+)=0.1molL-1,pH=1,但测得的pH>1,说明c(H+)<0.1molL-1,故答案为:>。
(3)证明CH3COOH是弱电解质,可选择已知的强电解质如盐酸做对照实验进行验证。如分别量取等体积、等物质量浓度的盐酸和醋酸,可向其中分别加入相同大小的过量Zn粒,比较相同的反应时间内收集到的H2的量或分别加水稀释相同倍数,比较二者稀释后的pH的变化值等方法。故答案为:用量筒量取0.1mol/L的盐酸和醋酸溶液各2mL,测量其pH值,然后分别加水稀释10倍,再次测量二者的pH值,比较二者稀释前后的pH的变化值△pH,可以看出![]() ,故醋酸为弱电解质。
,故醋酸为弱电解质。


科目:高中化学 来源: 题型:
【题目】设计出燃料电池使汽油氧化直接产生电流是本世纪最具有挑战性的课题之一。最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
⑴以丁烷为汽油代表,这个电池放电时发生的化学反应的方程式是:_______;
⑵这个电池负极发生的反应是:C4H10+13O2--26e-=4CO2+5H2O,正极发生的反应是:____;固体电解质里O2-的移动方向是:_____;向外电路释放电子的电极是:___;
⑶人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:_______;
⑷汽油燃料电池最大的障碍是氧化反应不完全产生_____堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
⑸碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2,溶于水达到平衡时,溶液的溶液的pH=5.6, c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 H++HCO3-的平衡常数K1=____(已知:10-5.60=2.5×10-6)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构如图所示,下列说法正确的是( )
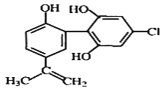
A.该分子中所有碳原子不可能位于同一平面
B.1mol该物质分别与浓溴水和NaOH溶液反应时最多消耗 Br2 4mol和NaOH 5mol
C.滴入酸性KMnO4溶液振荡,紫色褪去证明该物质结构中存在碳碳双键
D.该物质遇FeCl3溶液显紫色,属于苯酚的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①盐酸与足量锌片反应时,加入少量硫酸铜溶液可以加快反应速率且不影响生成氢气的物质的量
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
③对反应3H2(g)+N2(g)![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不变
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不变
④对于反应3KSCN(aq)+ FeCl3(aq)![]() Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①②④ B. ②③ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
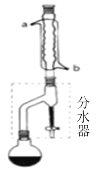
【题目】有一种水果香精乙酸正丁酯的合成提纯步骤如下:
(1)合成:在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇 、3~4滴浓H2SO4、7.2mL(7.5g,0.125mol)冰醋酸,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器(分离出生成的水)中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
(2)分离提纯:
① 当分水器中的液面不再升高时,冷却,从分水器下端放出分水器中的水,把反应后的烧瓶中的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分震荡后静置,分去水层。
② 将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO47H2O晶体)。
③ 将乙酸正丁酯粗产品转入50mL图中的仪器中,加几粒沸石进行加热,收集产品,主要试剂及产物的物理常数如下:
化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
制备过程中还可能存在的副反应有:2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O。根据以上信息回答下列问题:
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O。根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式_________。
(2)步骤①中碳酸钠溶液的作用主要是___________,若改用NaOH溶液洗涤酯层,收集到的产物比预期少,原因是:_____________。
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先___________(填实验操作名称),步骤③中加热分离有机物的实验方法名称是______________。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(5)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为86,如果分子中含有3个-CH3、2个-CH2-和1个![]() ,则该结构的烃的一氯取代物最多可能有(不考虑立体异构)( )
,则该结构的烃的一氯取代物最多可能有(不考虑立体异构)( )
A.9种B.8种C.5种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分:(不得用a~h字母回答)元素周期表有7个横行,每一个横行称为“周期”,周期序数=电子层数;元素周期表共有18列,每一列称为 “族”,下表中的7列为主族元素,分别用罗马数字Ⅰ、Ⅱ、……表明族序数,族序数=最外层电子数。
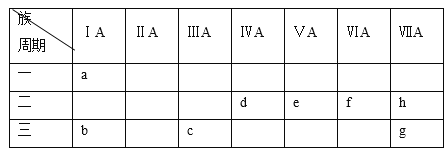
根据a~h各元素的性质,选择相应的化学符号、化学式或化学方程式填空:
(1)单质氧化性最强的是__________,酸性最强的含氧酸是_____________。
(2)写出e的碱性气态氢化物的电子式_____,将它和化合物df 2通入饱和食盐水发生反应的化学方程式是_____。
(3)最高价氧化物对应的水化物中,碱性最强的是___________。
(4)在b、c、g、h中,常见离子半径最大的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com