
【题目】某烃的相对分子质量为86,如果分子中含有3个-CH3、2个-CH2-和1个![]() ,则该结构的烃的一氯取代物最多可能有(不考虑立体异构)( )
,则该结构的烃的一氯取代物最多可能有(不考虑立体异构)( )
A.9种B.8种C.5种D.4种
科目:高中化学 来源: 题型:
【题目】下列几种情况,对中和滴定结果无影响的是
A.滴定管用水冲洗后即注入标准液B.锥形瓶里有少量水
C.滴定前标准液在“0”刻度以上D.滴定管尖端未充满液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.食醋常用于食品调味,其主要成分为醋酸。请回答:
(1)写出醋酸的电离方程式________________
(2)0.1mol/L醋酸溶液中加入少量盐酸,电离平衡向___反应方向移动(填“正”或“逆”)。
(3)在0.1mol/L醋酸溶液中加入少量醋酸钠晶体,晶体溶解后,醋酸溶液的pH____(选填“增大”“减小”或“不变”)。
(4)0.1mol/L醋酸溶液的pH____(选填“>”“=”或“<”)0.1mol/L盐酸溶液的pH。
(5)在0.1mol/L醋酸溶液中加入等体积等浓度的氢氧化钠溶液,反应后溶液显____性。
II.某同学想用实验确定CH3COOH是弱电解质。其方案是:
①称取一定质量的CH3COOH配制0.1molL-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HCOOH是弱电解质。
(1)方案的第①步中,要用到的玻璃定量仪器是______。
(2)该方案中,说明CH3COOH是弱电解质的理由是测得溶液的pH______1(选填>、<、=)。
(3)结合你所学的知识,试再提出一个简单易操作的可行方案证明CH3COOH是弱电解质(药品可任取)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道;D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有2个电子。
(1)F2+离子的电子排布式是_______________。
(2)B、C、D三种元素的电负性由大到小的顺序为___________________________
(3)B、C元素的某些氢化物的分子中均含有18个电子, B、C的这些氢化物的沸点相差较大的主要原因是________________________________________________。
(4)D、E可形成ED32-,则该离子的立体构型为____________;A、B、D可形成A2B2D4分子,1mol该物质能与2molNaHCO3反应,则1 mol该分子中含有π键的数目为________。
(5)如图表示F与E形成的化合物晶胞(黑球是F、白球是E),该化合物的化学式为________;该晶胞边长为540.0 pm,该晶体密度为____________g·cm-3
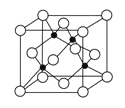
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可在一定条件下进行反应:M(g)+3N(g)![]() 2P(g)+2Q(g),改变条件测得化学反应速率如下,其中能正确表示反应最快速率的是( )
2P(g)+2Q(g),改变条件测得化学反应速率如下,其中能正确表示反应最快速率的是( )
A.v(M)=0.5mol·L-1·min-1B.v(N)=1.2mol·L-1·min-1
C.v(Q)=0.4mol·L-1·min-1D.v(P)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图表示的一些物质或概念间的从属关系中正确的是
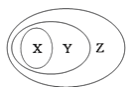
X | Y | Z | |
A | 液氯 | 非电解质 | 纯净物 |
B | 电解质 | 盐 | 化合物 |
C | 胶体 | 分散系 | 混合物 |
D | 酸性氧化物 | 非金属氧化物 | 氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1L无色待测液中除含有0.2mo/L的Na+外,还可能含下列离子中的一种或几种:
阳离子 | K+、NH4+、Ca2+、Ba2+、Fe3+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO42- |
现进行如图实验操作(每次实验所加试剂均过量)
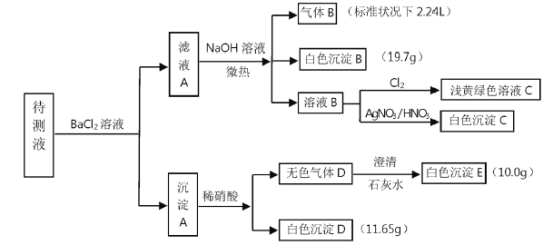
(1)由气体B可确定待测液中含有的离子是___________。
(2)由白色沉淀D和白色沉淀E可以判定待测液中一定含有的离子是___________,据此可以确定待液中一定不存在的离子是___________。
(3)由白色沉淀B可确定待测液中含有的离子是___________。
(4)某同学认为待液中一定不含溴离子,判断的依据是______________________。
(5)综上分析,待测液中K+的最小浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,分别向10 mL浓度均为1![]() 的两种弱酸HA,HB中不断加水稀释,并用pH传感器测定溶液
的两种弱酸HA,HB中不断加水稀释,并用pH传感器测定溶液![]() 。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。已知:pKa=-lgKa,下列叙述正确的是( )
。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。已知:pKa=-lgKa,下列叙述正确的是( )
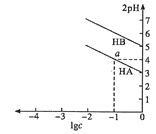
A.弱酸的Ka随溶液浓度的降低而增大
B.a点对应的溶液中c(HA)=0.1mol/L,pH=4
C.弱酸![]() 的pK≈5
的pK≈5
D.酸性: HA<HB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com