
【题目】黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:(绿矾化学式为FeSO4·7H2O)
![]()
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n( Fe) ×100%。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH一和Fe的物质的量。试回答下列问题。
(1)在绿矾中加人酸性介质的NaClO3目的是__________ 。
(2)SPFS溶于水后并与水反应生成__________ 能吸附水中的悬浮物来净化水。
(3)取15.05g某固体聚合硫酸铁溶解于水,向其中加人过量的BaCI2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀20.97g.向上述滤液中加人NH3H2O,调节溶液pH= 6,经过滤、洗涤、干燥得Fe2O3固体5.60g。该固体聚合硫酸铁的盐基度为_________ 。
(4)计算出该固体聚合硫酸铁样品的化学式______________(写出计算过程)。
【答案】将Fe2+氧化成Fe3+ Fe(OH)3胶体 14.3% Fe7(OH)3(SO4)9·11H2O
【解析】
(1)加入次氯酸钾、酸性介质,氯酸根离子具有氧化性,亚铁离子具有还原性,亚铁离子被氧化;
(2)实验室进行“蒸发”时用到的仪器有铁架台(带铁圈)、酒精灯和蒸发皿、玻璃棒;
(3)SPFS溶于水后并与水反应生成氢氧化铁胶体能吸附水中的悬浮物来净化水;
(4)根据Fe元素守恒计算n(Fe3+)=2n(Fe2O3),白色沉淀20.97g为BaSO4,而n(SO42-)=n(BaSO4),再根据电荷守恒计算n(OH-),再根据盐基度定义式计算;
(5)由聚合硫酸铁的质量,结合(4)各离子物质的量计算n(H2O),计算n(Fe3+):n(OH-):n(SO42-):n(H2O)比例关系确定化学式.
(1)在绿矾中加入酸性介质的NaClO3目的是:将Fe2+氧化为Fe3+,
故答案为:将Fe2+氧化为Fe3+;
(2)实验室进行“蒸发”时用到的仪器有铁架台(带铁圈)、酒精灯和蒸发皿、玻璃棒,
故答案为:蒸发皿、玻璃棒;
(3)SPFS溶于水后并与水反应生成氢氧化铁胶体能吸附水中的悬浮物来净化水,
故答案为:氢氧化铁胶体;
(4)根据Fe元素守恒:n(Fe3+)=2n(Fe2O3)=5.6g÷160g/mol×2=0.07mol,
白色沉淀20.97g为BaSO4,n(SO42)=n(BaSO4)=20.97g÷233g/mol=0.09mol,
根据电荷守恒:n(OH)=3×n(Fe3+)2×n(SO42)=3×0.07mol2×0.09mol=0.03mol,
则盐基度=0.03mol÷0.07mol÷3×100%=14.3%,
故答案为:14.3%;
(5)n(Fe3+)=0.07mol,m(Fe3+)=0.07mol×56g/mol=3.92g
n(SO42)=0.09mol,m(SO42)=0.09mol×96g/mol=8.64g,
n(OH)=0.03mol,m(OH)=0.03mol×17g/mol=0.51g,
m(H2O)=15.05g3.92g8.64g0.51g=1.98g,则n(H2O)=1.98g×18g/mol=0.11mol
n(Fe3+):n(OH):n(SO42):n(H2O)=0.07:0.03:0.09:0.11=7:3:9:11,
故该固体聚合硫酸铁样品的化学式为:Fe7(OH)3(SO4)911H2O,
故答案为:Fe7(OH)3(SO4)9·11H2O


科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g) + B(g)xC(g) + 2D(g),经4min后,测得D的浓度为0.4mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1 mol·(L ·min) -1。下列说法错误的是
A.A在4min末的浓度是0.6mol/LB.B在4min内的平均反应速率0.05 mol.L -1·min -1
C.x值是1D.起始时物质A的浓度为2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应____________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+) 由大到小的顺序是:①>②>③>④
B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+) +c(H+) =c(S2―) +c (HS―)+c (OH―)
D.AgCl悬浊液中存在平衡: AgCl(s)![]() Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:Zn+2H+=H2↑+Zn2+,设计如图所示原电池,观察到Y电极上有气泡产生,下列说法错误的是( )
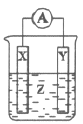
A.Y电极可能是铜
B.Z可能是硫酸铜溶液
C.电子流动方向:X→导线→Y
D.X电极的反应式:Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中常含有的NOx、SO2、H2S等污染物,容易形成酸雨,破坏环境。其综合治理是当前重要的研究课题。
Ⅰ.以下是对酸雨的若干项评价,其中不正确的是__________
a.杀死水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.导致臭氧层空洞
d.二氧化碳的过量排放,是形成酸雨的主要原因之一
Ⅱ.电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。

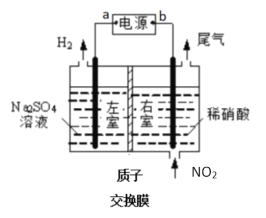
(1)电解NO制备NH4NO3原理如上方左图所示:
①阳极为石墨_____(填1或2),该电极的反应式为_____________。
②为使电解的副产物也完全转化为NH4NO3,需要补充的物质X的化学式为___________。
(2)用上方右图装置进行模拟电解NO2气体实验,可回收硝酸。
①外接电源a极为______极,左室发生的电极反应式为_____________。
②若有标准状况下2.24L NO2被吸收,通过质子交换膜(只允许质子通过)的H+为______mol。
③用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中增加了1 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28L H2。原气体中NO和NO2的体积比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com