
【题目】根据反应:Zn+2H+=H2↑+Zn2+,设计如图所示原电池,观察到Y电极上有气泡产生,下列说法错误的是( )
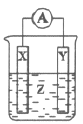
A.Y电极可能是铜
B.Z可能是硫酸铜溶液
C.电子流动方向:X→导线→Y
D.X电极的反应式:Zn-2e-=Zn2+
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.溴乙烷与少量乙醇的混合物加水除去乙醇的方法,原理类似于溴水中加四氯化碳萃取溴
B.中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果
C.由![]() 稀
稀![]() 构成的原电池,溶液中加入适量
构成的原电池,溶液中加入适量![]() 能提高电池放电效率
能提高电池放电效率
D.蛋白质与氨基酸遇到双缩脲试剂均会出现紫玫瑰色现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:(绿矾化学式为FeSO4·7H2O)
![]()
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n( Fe) ×100%。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH一和Fe的物质的量。试回答下列问题。
(1)在绿矾中加人酸性介质的NaClO3目的是__________ 。
(2)SPFS溶于水后并与水反应生成__________ 能吸附水中的悬浮物来净化水。
(3)取15.05g某固体聚合硫酸铁溶解于水,向其中加人过量的BaCI2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀20.97g.向上述滤液中加人NH3H2O,调节溶液pH= 6,经过滤、洗涤、干燥得Fe2O3固体5.60g。该固体聚合硫酸铁的盐基度为_________ 。
(4)计算出该固体聚合硫酸铁样品的化学式______________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L密闭容器中发生反应:![]() 。已知N2O5物质的量变化为图中曲线b。下列说法中正确的是( )
。已知N2O5物质的量变化为图中曲线b。下列说法中正确的是( )

A.0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a可表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新物质的发现、制备改变着我们的生活。下列物质或材料属于有机物的是( )
|
|
|
|
A.双氢青蒿素 | B.硅碳复合材料 | C.层状复合金属氧化物光催化材料 | D.砷化铌纳米带 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
|
|
|
|
① | ② | ③ | ④ |
A.装置①表示已组装的铜锌原电池
B.装置②工作一段时间后,a极附近溶液的pH减小
C.装置③可以在铁钉上镀铜
D.装置④保护铁闸门不被腐蚀,为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是![]()
A.![]() 与足量的铁粉充分反应转移的电子数为
与足量的铁粉充分反应转移的电子数为![]()
B.32g硫在足量的氧气中充分燃烧,转移电子数为![]()
C.![]() 溶液中所含
溶液中所含![]() 的数目为
的数目为![]()
D.![]() 和
和![]() 的固体混合物中含有的阳离子数为
的固体混合物中含有的阳离子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解CuSO4和Al2(SO4)3的混合液一段时间后,往溶液中加入0.5mol Cu2(OH)2 CO3恰好使溶液复原,则电解过程转移的电子的物质的量为( )
A.1 molB.2 molC.3 molD.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。写出反应的离子方程式:_______________________。
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(T) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol·L-1·min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________________________。
II.生活污水中的磷和氮主要以磷酸盐和铵盐形式存在。
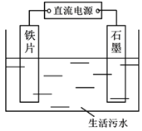
(1)除磷的原理如上图所示,利用电解法将PO43-转化为Fe3(PO4)2沉淀除去。铁作___________,(填“阴极”“阳极”),用化学用语表示产生Fe2+的主要过程:__________________________。
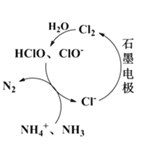
(2)有Cl-存在时,除氮原理如图所示,主要依靠电解产生的有效氯(HClO、ClO-)将NH4+或NH3氧化为N2.当pH<7时,主要发生HClO氧化NH4+的反应,其离子方程式为:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com