
��Ҫ����ա�
(1)��S2����Fe2����Fe3����Mg2����S��I����H���У�ֻ�������Ե��� ��ֻ�л�ԭ�Ե��� ���������������л�ԭ�Ե��� ��
(2)ijͬѧд������������ѧ����ʽ(δ��ƽ)
��NO��HNO3�D��N2O3��H2O
��NH3��NO�D��HNO2��H2O
��N2O4��H2O�D��HNO3��HNO2
��������Ϊһ��������ʵ�ֵ��� ��
(3)��������������ԭ��Ӧ�У���������ǿ�������� ��
��2FeCl3��2KI=2FeCl2��2KCl��I2
��2FeCl2��Cl2=2FeCl3
��2KMnO4��16HCl(Ũ)=2KCl��2MnCl2��5Cl2����8H2O
��������Cl����I�����棬Ϊ������I����Cl�������������������⣬��Ӧ��������Ӧ�е� ����������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪Br2+ 2Fe2+ = 2Fe3++ 2 Br-������1 molFeBr2��Һ����ͨ��Cl2����Һ����һ���Br-����ʱ�������жϲ���ȷ����
| A����Ӧǰ����Һ����ɫ�����˸ı� |
| B����Ӧ����Һ��c(Cl-)= C(Br-) |
| C���μӷ�Ӧ��Cl2Ϊ1 mol |
| D����Ӧ�����ӷ���ʽΪ��2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣�X��Y��Z��W��PΪ�����ڵ�����Ԫ�أ���ԭ��������������Y��Z��W��Pλ��ͬһ���ڡ�X Ԫ���γɵĵ�������Ȼ���к����������壬1mol Y�ĵ��ʷֱ����������������������Һ��Ӧ���ɵ������ڱ���¾�Ϊ33.6L��W��ԭ������������������������֮��Ϊ3��8��X��ԭ��������Z��ԭ��������һ�롣
(1)Y�����ڱ��е�λ����________��X���⻯����P���⻯��ӽ�ʱ��������_________��
(2)W��P���γ�ԭ�Ӹ�����Ϊ1��2�Ļ���������ʽΪ__________��
(3)Y��P�γɵĻ�������Һ��____�ԣ������ӷ�Ӧ����ʽ��ʾ���������ʵ�ԭ��________________��
(4)Z��W��P����Ԫ�ص���̬�⻯���ȶ����ɸߵ��͵�˳����______________________���ѧʽ����
(5)X���������������ӹ�ҵ�������ĵ����ӿ�ʴ���壬���ڳ�ʪ�Ļ���������ˮ������Ӧ������ɫ���壬��������Ϊ����ɫ��д��������������ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽ_____����0.6mol X������������ȫ��ˮ��Ӧ����ת�Ƶĵ�������ԼΪ_________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���������£���ͭ��(��Ҫ�ɷ�ΪCu2S)ͨ�����Ŀ�����ұ������ͭ������һϵ�з�Ӧ�ɵõ�B��D��E��GΪש��ɫ������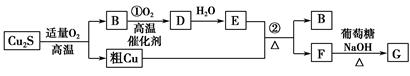
��ش��������⣺
(1)��ͭ��(Cu2S)ͨ�����Ŀ���ұ������ͭ�Ļ�ѧ����ʽΪ ������������Ϊ ��
(2)E��Ũ��Һ��Cu������Ӧ�ڵĻ�ѧ����ʽ�� ��
(3)���õ����ᴿͭ���ڸõ�ⷴӦ������������ ���������Һ�� ��
(4)��Ȼ���е��������������(��Ҫ�ɷ�ΪFeS2)����ʱ�Ỻ���������з�Ӧ������ͭ�Է�Ӧ��14CuSO4��5FeS2��12H2O=7Cu2S��5FeSO4��12H2SO4������������ͱ���ԭ�����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪�������ԣ�KMnO4��HNO3��Biλ�����ڱ��Т�A�壬��3�۽��ȶ���Bi2O3Ϊ���������Bi3������ҺΪ��ɫ��ȡһ���������ữ��Mn(NO3)2��Һ���ν�������ʵ�飬�����¼���£�
�������м���������NaBiO3����Һ��Ϊ�Ϻ�ɫ���ڼ����μ�����H2O2���Ϻ�ɫ��ȥ���������ݲ��������ټ���������PbO2���壬�����ܽ⣬��Һ�ֱ�Ϊ�Ϻ�ɫ��
�ش��������⣺
(1)д��ʵ��ٷ�Ӧ�����ӷ���ʽ�� ��
(2)KMnO4��H2O2��PbO2��������ǿ������˳��Ϊ ��
(3)��Ӧ�۵õ�����Һ��ͨ��SO2���壬������������ ��
(4)��ʵ��ڷų���336 mL����(��״��)����Ӧ�ٱ�������Mn(NO3)2Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ȵ�ϡ�������ܽ���11.4 g FeSO4���壬������50 mL 0.5 mol��L��1 KNO3��Һʱ�����е�Fe2��ȫ��ת����Fe3����KNO3Ҳ��ȫ��Ӧ���ų�NxOy���塣
(1)�����x�� ��y�� ��
(2)��ƽ�÷�Ӧ�ķ���ʽ��
FeSO4�� KNO3�� H2SO4= K2SO4�� Fe2(SO4)3��  (NxOy)�� H2O(��ƽʱx��y�þ�����ֵ��ʾ����������
(NxOy)�� H2O(��ƽʱx��y�þ�����ֵ��ʾ���������� ��)��
��)��
(3)��Ӧ������������ ��
(4)��˫���ŷ���ʾ�÷�Ӧ�еĵ���ת�Ʒ������Ŀ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����������Ļ������ڹ�����ռ����Ҫ��λ���ϳɰ���ҵ�У��ϳ�����ÿ����2 mol NH3���ų�92��4 kJ������
��1������ʼʱ�������ڷ���2 mol N2��6 mol H2����ƽ���ų�������ΪQ����Q 184��8kJ���>������<����=������һ�������£����ܱպ��ݵ������У��ܱ�ʾ��Ӧ�ﵽ��ѧƽ��״̬���� ��
a��3v��(N2)=v��(H2�� b��2v��(H2)= v��(NH3��
c����������ܶȱ��ֲ��� d��c(N2)��c(H2)��c(NH3)=1��3��2
��ҵ�������ص�ԭ������NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]����Ӧ�Ļ�ѧ����ʽΪ
2NH3 (g)+ CO2 (g�� CO(NH2)2 (l��+ H2O (l)��
CO(NH2)2 (l��+ H2O (l)��
��2����һ���¶Ⱥ�ѹǿ�£���ԭ�����е�NH3��CO2�����ʵ���֮�ȣ���̼�ȣ�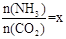 ����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
��3��ͼ�е�B�㴦��NH3��ƽ��ת����Ϊ ��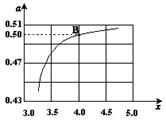
��4����֪�� 3Cl2+2NH3��N2+6HCl �D�D�� 3Cl2+8NH3��N2+6NH4Cl �D�D��
��ɲ���ƽ����������ԭ��Ӧ����ʽ��12Cl2+15NH3�� �D�D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2��SO2 ��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ �����÷�Ӧ6NO2�� 8NH3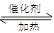 7N2��12 H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������ L��
7N2��12 H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������ L��
��2����֪��2SO2��g��+O2��g��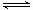 2SO3��g�� ��H="-196.6" kJ��mol-1
2SO3��g�� ��H="-196.6" kJ��mol-1
2NO��g��+O2��g��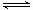 2NO2��g�� ��H="-113.0" kJ��mol-1
2NO2��g�� ��H="-113.0" kJ��mol-1
��ӦNO2��g��+SO2��g��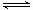 SO3��g��+NO��g���Ħ�H= kJ��mol-1��
SO3��g��+NO��g���Ħ�H= kJ��mol-1��
һ�������£���NO2��SO2�������1:2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��[��Դ:Z|xx|k.Com]
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1 mol SO3��ͬʱ����1 molNO2
���������Ӧƽ��ʱNO2��SO2�����Ϊ1:6����ƽ�ⳣ��K�� ��
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��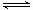 CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H 0���>���� <������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��
CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H 0���>���� <������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��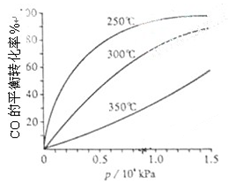
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������(K2FeO4)���к�ǿ�������ԣ����������������й㷺Ӧ�á�
��1��K2FeO4��������Чˮ�����������������÷ֱ��ǣߣߣߣߣߡ�
[��֪��FeO42����3e����4H2O Fe(OH)3��5OH��]
Fe(OH)3��5OH��]
��2���Ʊ�K2FeO4���Բ���ʪʽ����������������ͼ��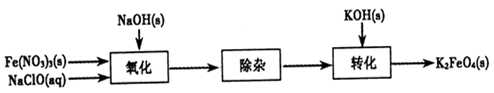
�����������������ӷ���ʽ��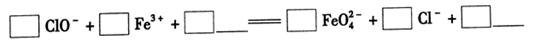
�ڳ��ӹ���Ŀ���dz�ȥNa��FeO4��Һ�е����ʣ���ȥ��������Ҫ�Уߣߣߣߣ�(д��ѧʽ)��
��ת�����������ij�¶��½��У�����¶����ܽ�ȣ�Na��FeO4�ߣߣߣߣ�K2FeO4 (�����������������)��
��3��ʵ����ģ�ҵ��ⷨ��ȡK2FeO4��װ������ͼ��
�ٴ�װ���е�Դ�ĸ����ǣߣߣߣ�(�a����b��)��
�������ĵ缫��ӦʽΪ�ߣߣߣߣߣߡ�
��4����֪K2FeO4ϡ��Һ�д�������ƽ�⣺4FeO42����10H2O 4Fe(OH)3��8OH����3O2��ʵ����K2FeO4��ҺŨ�����¶Ⱥ�pH�Ĺ�ϵ�ֱ�����ͼ��ʾ��
4Fe(OH)3��8OH����3O2��ʵ����K2FeO4��ҺŨ�����¶Ⱥ�pH�Ĺ�ϵ�ֱ�����ͼ��ʾ��
����ͼI�ɵó��Ľ��ۣ��÷�Ӧ�ġ��ȣߣߣ�0(�����������������)��
��ͼ����pH���ߣߣ�pH3(�����������������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com