
(14分)X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X 元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3:8,X的原子序数是Z的原子序数的一半。
(1)Y在周期表中的位置是________;X的氢化物与P的氢化物接近时的现象是_________。
(2)W与P可形成原子个数比为1:2的化合物,其电子式为__________。
(3)Y与P形成的化合物溶液显____性;用离子反应方程式表示显这种性质的原因________________。
(4)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是______________________(填化学式)。
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。写出此三氟化物与水反应的化学反应方程式_____,若0.6mol X的三氟化物完全与水反应,则转移的电子总数约为_________个。
(1)第三周期第ⅢA族;产生大量白烟 (2)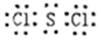
(3)酸;Al3++3H2O Al(OH)3+3H+ (4)HCl H2S SiH4
Al(OH)3+3H+ (4)HCl H2S SiH4
(5)3NF3+5H2O═2NO↑+HNO3+9HF;2.408×1023
解析试题分析:X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大,Y、Z、W、P位于同一周期,X元素形成的单质是自然界中含量最多的气体,则X是N元素;1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L,能和盐酸、氢氧化钠溶液反应且放出气体的物质只有Al,所以Y是Al元素;W的原子最外层电子数与核外电子总数之比为3:8,W的原子序数大于13,且为短周期元素,所以其最外层电子数与其核外电子总数分别是6、16,则W是S元素;X的原子序数是Z的原子序数的一半,所以Z是Si元素,P为短周期主族元素,且原子序数大于16,所以P是Cl元素。
(1)铝元素的原子序数是16,在周期表中的位置是第三周期第ⅢA族;氨气与氯化氢混合迅速反应生成氯化铵,产生大量白烟。
(2)S与Cl可形成原子个数比为1:2的化合物为SCl2,每个氯原子形成1个共用电子对、硫原子形成2个共用电子对,所以其电子式为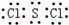 。
。
(3)Y与P形成的化合物是氯化铝,其溶液显酸性,是由于铝离子水解导致的,离子方程式为Al3++3H2O Al(OH)3+3H+。
Al(OH)3+3H+。
(4)元素非金属性越强,其氢化物越稳定,同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以其氢化物越稳定,因此Si、S、Cl三种元素的气态氢化物稳定性由高到低的顺序是 HCl>H2S>SiH4。
(5)NCl3在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色,说明生成NO,同时还生成硝酸和氢氟酸,该反应的化学方程式为3NF3+5H2O═2NO↑+HNO3+9HF,根据NCl3与转移电子之间的关系式得,转移电子数=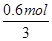 ×1×(5?3)NA/mol=2.408×1023。
×1×(5?3)NA/mol=2.408×1023。
考点:考查元素推断、元素周期律的应用、水解、常见化学用语书写以及氧化还原反应的计算等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下列物质的应用不涉及氧化还原反应的是
| A.用稀硝酸洗去附在试管内壁的银镜 |
| B.用热的纯碱溶液清洗油污 |
| C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病 |
| D.在铁质镀件上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。
完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____________________。
(3)在20.00mL的0.1mol/L VO2+溶液中,加入 0.195g锌粉,恰好完成反应,则还原产物可能是__________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
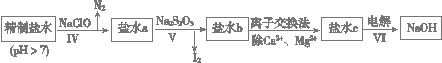
(16分)MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下: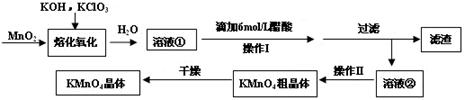
(1)写出“溶化氧化”的化学反应方程式: ;
(2)从溶液②中得到KMnO4粗晶体的方法是 ;
(3)上述流程中可以循环使用的物质是 ;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的 mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因: ;
②不采用硫酸的原因: 。
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式 ;
②电解K2MnO4溶液,电解的总反应离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电解饱和食盐水的反应为2NaCl+2H2O Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。
27. 在上述方程式上标出电子转移的方向和数目。
28. 该反应中被氧化的元素是 。阴极产物之一为H2,阴极上发生的变化为 反应(选填“氧化”、“还原”)。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。
a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O
c.CuCl2 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe 2FeCl3
2FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如下图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列
问题: 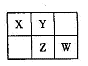
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3)AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高
反应速率,又能提高原料转化率的是 。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被200 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
其中你认为一定不可能实现的是 。
(3)下列三个氧化还原反应中,氧化性最强的物质是 。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的 作氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度 b.氨水的电离程度
c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”或“不相同”),其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com