
��16�֣�MnO2���������KOH��KClO3�ڸ����·�Ӧ����������أ�K2MnO4����KCl��K2MnO4��Һ���ữ��ת��ΪMnO2��KMnO4��һ��MnO2�Ʊ�KMnO4�ķ������£�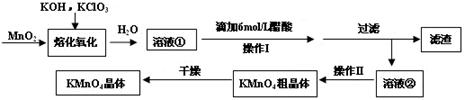
��1��д�����ܻ��������Ļ�ѧ��Ӧ����ʽ�� ��
��2������Һ���еõ�KMnO4�־���ķ����� ��
��3�����������п���ѭ��ʹ�õ������� ��
��4�������ϣ����������Ʊ������е���ʧ������ѭ����1mol MnO2���Ƶ� mol KMnO4��
��5����֪293Kʱ����ص��ܽ��Ϊ217g������ص��ܽ��Ϊ11.1g��������ữ�����в��ô��������������������ԭ��
�ٲ����������ԭ�� ��
�ڲ����������ԭ�� ��
��6���������������Ʊ�KMnO4���ʲ����ߣ�Ϊ��߲��ʣ������Բ����������ַ�����
����K2MnO4��Һ��ͨ��������д���÷�Ӧ�����ӷ���ʽ ��
�ڵ��K2MnO4��Һ�������ܷ�Ӧ���ӷ���ʽΪ ��
��1��6KOH + KClO3 + 3MnO2 3K2MnO4 + KCl + 3H2O ��3�֣�
3K2MnO4 + KCl + 3H2O ��3�֣�
��2������Ũ������ȴ�ᾧ������ ��2�֣�
��3��MnO2 ��2�֣�
��4��2/3 ��2�֣�
��5����������л�ԭ�ԣ�������ؾ���ǿ�����ԣ���������� ��1�֣�
��������ܽ�Ƚ��ͣ�������Ũ��������������������ɲ�Ʒ������ش����½���1�֣�
��6��2MnO42- + Cl2 = 2MnO4- + 2Cl-��2�֣�
2MnO42- + 2H2O = 2MnO4- + 2OH- + H2����3�֣�
�������������1����һ�����������ҵ���Ӧ��Ͳ���������ٸ��ݵ���غ���ƽ��Ӧ��۵�Ԫ�أ�����õ���غ��һ����ƽ����
��2���ؼ��������⡰��Һ���еõ�KMnO4�־��塱
��3����ѭ������Ϊ���Դӡ��ӽ�ȥ���͡��������������ʽ��п���
��4������6KOH + KClO3 + 3MnO2 = 3K2MnO4 + KCl + 3H2O
�� 3MnO42- + 4H+ = 2MnO4- + MnO2 ��+ 2H2O
������ϵʽ��3MnO2�� 3MnO42-�� 2MnO4-
����ϵ�����м��㼴��
��5�������������ķ��������������ط�Ӧ��֪
���ɸ������ܽ�ȡ�����ص��ܽ��Ϊ11.1g����֪
��6�����������֪�������Ҫת��Ϊ�������Ҫ����������������䵱������
�������Ҫת��Ϊ������أ��������Ҫ�������ŵ磬�����������Һ�����ӳɷݣ������ڵ�ⱥ��ʳ��ˮ��
���㣺������ԭ��Ӧ���йؼ��㣻����͵����ķ������绯ѧ�е��صĵ缫��Ӧʽ����д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�飨Bi��λ��Ԫ�����ڱ���VA�壬���̬Ϊ+3ʱ���ȶ��������ƣ�NaBiO3�������������̣�MnSO4������Ӧ�����ӷ���ʽΪ5NaBiO3+2Mn2++14H+��2MnO- 4+5Bi3++Na++7H2O������˵���������
| A������0.1mol�����������ɣ���ת��0.5mol���� |
| B��������������ˮ |
| C���÷�Ӧ�������ڼ���Mn2+���� |
| D���÷�Ӧ������Ũ�����ữ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪Br2+ 2Fe2+ = 2Fe3++ 2 Br-������1 molFeBr2��Һ����ͨ��Cl2����Һ����һ���Br-����ʱ�������жϲ���ȷ����
| A����Ӧǰ����Һ����ɫ�����˸ı� |
| B����Ӧ����Һ��c(Cl-)= C(Br-) |
| C���μӷ�Ӧ��Cl2Ϊ1 mol |
| D����Ӧ�����ӷ���ʽΪ��2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ƣ�NaH2PO2�������ڻ�ѧ������
��1����ѧ��������Һ�к���Ni2+��H2PO2���������������·������¶�����Ӧ��
�� Ni2+ + H2PO2��+ �� Ni + H2PO3��+
�� 6H2PO2- +2H+ ��2P+4H2PO3-+3H2��
����ƽ��Ӧʽ�١�
��2����Ӧʽ���л�ԭ���� ������ԭԪ���� ��
��3����Ӧ���У�������1 mol H2PO3-����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ mol��
��4���Ӷ�����Ӧ������������1mol Ni��1mol P��ͬʱ�� mol H2PO3�����ɡ�
��5��������и�С���еĻ�ѧ��Ӧ����ʽ��
�������O2��Ӧ����������ϸ��ӣ�����ͨ�������K2O�����������K2O2�����г�������ͳ�������ȡ�Ҫ�Ʊ����������ͨ������һ�����ü������ԭ��Ӧ�Ĺ�����������λ��������Ρ�д�����л�ѧ��Ӧʽ��
������������Ʒ�Ӧ
�ڼػ�ԭ����أ�ͬʱ��������һ�ֵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��12�֣�����HNO3����ʱ����ԭ�������HNO3Ũ���й��⣬�����¶��йء���֪��
�����ϡHNO3��Ӧʱ����Ҫ��ԭ����ΪNO���壻���ȵ�ϡHN03��Ӧʱ����Ҫ��ԭ����
ΪN2O���壻��HNO3��ϡʱ������Ҫ��ԭ������NH4+����������ϡ HNO3�����ã������
��ͼ���ش��й����⡣
�������ߵĸ�����ֻ��һ�ֻ�ԭ���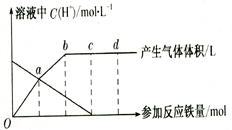
��1��0�㵽a��Ļ�ԭ������ ________ __��
��2��a�㵽b��Ļ�ԭ������__ __����ԭ���� ��
��3�������b�㵽c��ķ�Ӧ����ʽ��
��Fe+��HNO3������Fe( NO3)3+��[ ]+��H20��
��4����Ӧ�����У����� ________ ��ʱ,HN03����ȫ��Ӧ��
��5����֪�ﵽd��ʱ��Ӧ��������ʱ��Һ�е���Ҫ�������� ��
��6��c���d��μӷ�Ӧ���������ʵ���֮���� ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������п��һ�ֶ���Ե����������ϣ��������СԼ��1-100���ס�ij����ұ���о�������ʪ��ѧ��(NPP-��)�Ʊ�������������п�����ø��ֺ�п����Ϊԭ�ϣ����������п��������ξ�����ȥԭ���е����ʣ�Ȼ�������ü�ʽ̼��п������û�������п����ѧ�����������£�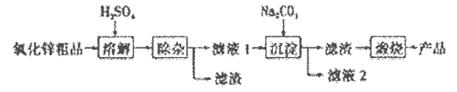
��1��ͨ��__________����������ƣ����Լ�����������Һ2�к���Na����
��2������������ͼ��Na2CO3��Һ��pH��12������˵����ȷ����___________��
A����Һ��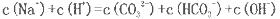
B������Һ��
C������Һ��
D����������Һϡ����100������pH��10��
��3�����ܽ⡱��õ���������Һ�к���Zn2����SO42����������Fe2����Cu2�������ʡ�ȡ0.5L����Һ�ȼ���___________���Na2CO3����H2SO4����������Һ��pH��5.4��Ȼ���������KMnO4��Fe2��ת��ΪFe(OH)3��ͬʱKMnO4ת��ΪMnO2���������Һ��Fe2����Ũ��Ϊ0 009 mol/L�������Һ������Ӧ����_______molKMnO4 .
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣�X��Y��Z��W��PΪ�����ڵ�����Ԫ�أ���ԭ��������������Y��Z��W��Pλ��ͬһ���ڡ�X Ԫ���γɵĵ�������Ȼ���к����������壬1mol Y�ĵ��ʷֱ����������������������Һ��Ӧ���ɵ������ڱ���¾�Ϊ33.6L��W��ԭ������������������������֮��Ϊ3��8��X��ԭ��������Z��ԭ��������һ�롣
(1)Y�����ڱ��е�λ����________��X���⻯����P���⻯��ӽ�ʱ��������_________��
(2)W��P���γ�ԭ�Ӹ�����Ϊ1��2�Ļ���������ʽΪ__________��
(3)Y��P�γɵĻ�������Һ��____�ԣ������ӷ�Ӧ����ʽ��ʾ���������ʵ�ԭ��________________��
(4)Z��W��P����Ԫ�ص���̬�⻯���ȶ����ɸߵ��͵�˳����______________________���ѧʽ����
(5)X���������������ӹ�ҵ�������ĵ����ӿ�ʴ���壬���ڳ�ʪ�Ļ���������ˮ������Ӧ������ɫ���壬��������Ϊ����ɫ��д��������������ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽ_____����0.6mol X������������ȫ��ˮ��Ӧ����ת�Ƶĵ�������ԼΪ_________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���������£���ͭ��(��Ҫ�ɷ�ΪCu2S)ͨ�����Ŀ�����ұ������ͭ������һϵ�з�Ӧ�ɵõ�B��D��E��GΪש��ɫ������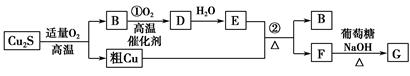
��ش��������⣺
(1)��ͭ��(Cu2S)ͨ�����Ŀ���ұ������ͭ�Ļ�ѧ����ʽΪ ������������Ϊ ��
(2)E��Ũ��Һ��Cu������Ӧ�ڵĻ�ѧ����ʽ�� ��
(3)���õ����ᴿͭ���ڸõ�ⷴӦ������������ ���������Һ�� ��
(4)��Ȼ���е��������������(��Ҫ�ɷ�ΪFeS2)����ʱ�Ỻ���������з�Ӧ������ͭ�Է�Ӧ��14CuSO4��5FeS2��12H2O=7Cu2S��5FeSO4��12H2SO4������������ͱ���ԭ�����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2��SO2 ��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ �����÷�Ӧ6NO2�� 8NH3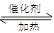 7N2��12 H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������ L��
7N2��12 H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������ L��
��2����֪��2SO2��g��+O2��g��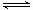 2SO3��g�� ��H="-196.6" kJ��mol-1
2SO3��g�� ��H="-196.6" kJ��mol-1
2NO��g��+O2��g��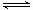 2NO2��g�� ��H="-113.0" kJ��mol-1
2NO2��g�� ��H="-113.0" kJ��mol-1
��ӦNO2��g��+SO2��g��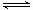 SO3��g��+NO��g���Ħ�H= kJ��mol-1��
SO3��g��+NO��g���Ħ�H= kJ��mol-1��
һ�������£���NO2��SO2�������1:2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��[��Դ:Z|xx|k.Com]
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1 mol SO3��ͬʱ����1 molNO2
���������Ӧƽ��ʱNO2��SO2�����Ϊ1:6����ƽ�ⳣ��K�� ��
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��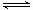 CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H 0���>���� <������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��
CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H 0���>���� <������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��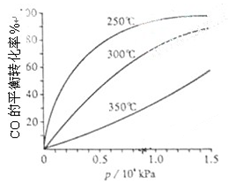
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com