
已知Br2+ 2Fe2+ = 2Fe3++ 2 Br-,当向含1 molFeBr2溶液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl-)= C(Br-) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.浓硫酸可干燥H2、SO2、NH3等气体 |
| B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生 |
| C.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| D.足量的硫单质与64g铜反应,有2mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的应用不涉及氧化还原反应的是
| A.用稀硝酸洗去附在试管内壁的银镜 |
| B.用热的纯碱溶液清洗油污 |
| C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病 |
| D.在铁质镀件上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
| A.1∶1∶3 | B.1∶2∶4 | C.1∶1∶4 | D.1∶3∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是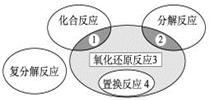
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3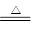 Na2CO3+H2O +CO2↑ Na2CO3+H2O +CO2↑ |
| C.Zn +H2SO4= ZnSO4 + H2↑ |
D.CuO+CO 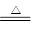 Cu + CO2 Cu + CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
判断下列有关化学基本概念的依据正确的是
| A.胶体:组成物质的直径是否在1nm~100nm之间 |
| B.氧化还原反应:反应前后元素的化合价是否发生了变化 |
| C.共价化合物:组成化合物的元素是否全部都是非金属元素 |
| D.化学变化:是否有热效应、颜色变化、气体或沉淀生成等四种实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。
完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____________________。
(3)在20.00mL的0.1mol/L VO2+溶液中,加入 0.195g锌粉,恰好完成反应,则还原产物可能是__________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下: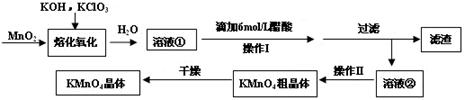
(1)写出“溶化氧化”的化学反应方程式: ;
(2)从溶液②中得到KMnO4粗晶体的方法是 ;
(3)上述流程中可以循环使用的物质是 ;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的 mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因: ;
②不采用硫酸的原因: 。
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式 ;
②电解K2MnO4溶液,电解的总反应离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
其中你认为一定不可能实现的是 。
(3)下列三个氧化还原反应中,氧化性最强的物质是 。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的 作氧化剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com