
����Ŀ����������淋Ļ�ѧʽΪ(NH4)2SO4��FeSO4��6H2O������Ī���Σ��Ƿ�����ѧ�г����Ļ�ԭ����ij��ѧ�о�С���������ʵ�����Ʊ�Ī���β��ⶨ��������淋Ĵ��ȡ�
����һ����м�Ĵ������������ʢ��������м����ƿ�м���Na2CO3��Һ�����ȡ����ˡ�ϴ�ӡ����������������Ϊm1��
�������FeSO4���Ʊ�����������м���뵽һ������ϡ�����У���ַ�Ӧ����˲���������ˮϴ����ƿ����ֽ����Һ��ϴ��Һ��ȫת�����������С������������أ�������Ϊm2��
����������������淋��Ʊ���ȷ��ȡ����������(NH4)2SO4���롰��������е��������У���������һ��ʱ���ֹͣ����ȴ������������什ᾧ����ˡ���������ˮ�Ҵ�ϴ�Ӳ���Ȼ����������þ���������
�����ģ��ñ�ɫ���ⶨ��������淋Ĵ��ȡ�
�ش��������⣺
��1���������г�ȡ��(NH4)2SO4����Ϊ��
��2������м��Na2CO3��Һ������Ŀ������
�Ʊ�FeSO4��Һʱ������ͼװ�ó��ȹ��ˣ�ԭ������
�ڽ�(NH4)2SO4��FeSO4��Ϻ���ȡ�Ũ����ֹͣ���ȵ�ʱ������
�۱�ɫ���ⶨ��������林��ȵ�ʵ�鲽��Ϊ��Fe3����ɫ�����ơ����������������Һ�����ơ���ɫ�ⶨ����ɫ�ʹ���Һ����ʱ�������������ϡ�����⣬��Ӧע�����������
�ܸ�ʵ������ͨ��ȷ����������鱗�Ʒ�ȼ���
���𰸡�
��1�� ![]() ��132
��132
��2����ȥ��м��������ۣ��ӿ�������ʣ���ֹFeSO4�����������ȹ��˷�ֹFeSO4����Һ��������Ũ����Һ�������ֽྻ��Ĥ����ɫ�ʹ���Һ��Ũ���൱��������Һ���ɫ�ĺ�ɫ���б�ɫ
��������(1)���ݷ�Ӧ������������m(Fe)��m1��m2�������ɼ��������FeSO4�����ʵ�����ȷ��(NH4)2SO4�����ķ�����Fe��FeSO4��(NH4)2SO4 �� �������г�ȡ��(NH4)2SO4����Ϊ ![]() ��132��(2)��Na2CO3��Һ��һ�ּ�����Һ�����ݶ�ԭ�ϳ���Ҫ�����Ƴ��ù����dz�ȥԭ���ϵ����ۡ����ڼ���ԭ��������ˮ��֪ʶ��֪�������¶ȣ��ٽ���Na2CO3��ˮ�⣬��Һ������ǿ��ȥ����������ǿ����Ũ���ᾧĪ����ʱҪ��С����ȣ�����Ũ�����ڿ������裬��ע��۲쾧Ĥ�����о�Ĥ���֣���ֹͣ���ȣ���ֹĪ����ʧˮ���������������ɣ�����ʱ��Һ�е��������ӻᱻ���뾧���У�������ܻ����ȷֽ���������۴���Һ������Ӧ��֤�䴦�ڱ���Һ(ɫ��)��Ũ�ȷ�Χ֮�ڡ��ܸ�ʵ������ͨ��������Һ���ɫ�ĺ�ɫ���бȽ�ȷ����������鱗�Ʒ�ȼ���
��132��(2)��Na2CO3��Һ��һ�ּ�����Һ�����ݶ�ԭ�ϳ���Ҫ�����Ƴ��ù����dz�ȥԭ���ϵ����ۡ����ڼ���ԭ��������ˮ��֪ʶ��֪�������¶ȣ��ٽ���Na2CO3��ˮ�⣬��Һ������ǿ��ȥ����������ǿ����Ũ���ᾧĪ����ʱҪ��С����ȣ�����Ũ�����ڿ������裬��ע��۲쾧Ĥ�����о�Ĥ���֣���ֹͣ���ȣ���ֹĪ����ʧˮ���������������ɣ�����ʱ��Һ�е��������ӻᱻ���뾧���У�������ܻ����ȷֽ���������۴���Һ������Ӧ��֤�䴦�ڱ���Һ(ɫ��)��Ũ�ȷ�Χ֮�ڡ��ܸ�ʵ������ͨ��������Һ���ɫ�ĺ�ɫ���бȽ�ȷ����������鱗�Ʒ�ȼ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A���̼�����Ԫ�صĻ��������о�����������������Ҫ��;����ش�����������
��1���ڻ�̬14C ԭ�������������__________�������෴�ĵ���;CO32- ���ӵļ��ι���Ϊ__________��
��2�����÷�ӦCu2Cl2+C2H2+2NH3��Cu2C2(��Ȳ��ͭ����ɫ)+2NH4Cl �ɼ�����Ȳ����Ȳ������������������Ŀ֮��Ϊ__________��NH4Cl �к��еĻ�ѧ��������__________��
��3�������ӻ�����ƺͺϳ������о�����֮һΪ�����ӿ������������ӿ��������������ӱ����������������йء�
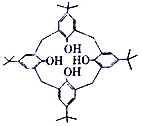
����ͼΪ���嶡����[4]��������4 ���ǻ����ɱ��ף��ǻ�������������__________�����嶡����[4]������̼ԭ�ӵ��ӻ���ʽ��__________��
��������������ijЩ��B��Ԫ�ؽ���������57La3+��21Se2+ ����ȡ����̬Se2+��������Ų�ʽΪ__________��
��4���衢����������Ԫ���γ���̬�⻯�����Si-H���й��õ��Ӷ�ƫ����Ԫ�أ�����������Ӧʱ�����������������������ĵ縺����Դ�СΪSe__________(����>������<��)Si��
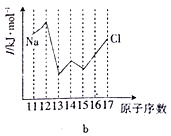
��Siͬ���ڵIJ���Ԫ�صĵ�����(I)��ͼ��ʾ�����д����ڶ������ܵ�ͼ��__________(����)��


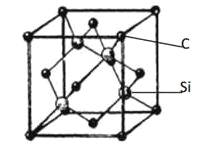
��5�����ɰ(SiC)�ľ����ṹ����ͼ��ʾ��ÿ��Cԭ����Χ���������Cԭ����ĿΪ__________��;�������ı߳�Ϊa pm������ɰ���ܶȱ���ʽΪ__________g �� cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ��������������ȷ���ǣ�NA��ʾ����٤����������������
A.7.8g�������ƺ��еĹ��õ��Ӷ���Ϊ0.2NA
B.2H2O2��l��=2H2O��l��+O2��g����H=98.2 kJ/mol����S=70.5 J/mol��K���÷�Ӧ�������Է�����
C.��������ʹ���������Һ��ɫ��1mol��������õ�2NA����
D.�ں���NH4+��Ba2+��Cl-��NO3-���ӵ���Һ �������������������ϸ�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ�صĺ������ʼ첿�ź�������������Ҫָ�꣬ʵ����Ҫ�������²��裺
������0.01 mol��L��1��0.008 mol��L��1��һϵ��Ũ�ȵ�[Fe(SCN)6]3��(��ɫ)����ɫҺ��
����Ʒ������![]()
��ȷ��ȡһ������Ĵ���Һ�ڱ�ɫ���У������Թ�����KSCN��Һ����ϡ�͵�10 mL��
�ܱ�ɫ��ֱ����ѡȡ�ı���ɫһ�»�������ɡ�
�Իش��������⣺
��1������100 mL 0.01 mol��L��1��Һ����Ҫ�IJ��������У��ձ���������������Ҫ������
��2���������ɫ���̰������룺(�����л�ɫ�ص�����������)��������С���ȴ��(�����)��
��3����ɫ��ȷ������Һ��Ũ�ȵ�ԭ������
��4�����䲹������������[CH3CH(OH)COOH]�������������ɵģ���д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������IJⶨ�����Ƕ��ֶ����ģ�
�������������IJⶨ���Ƚ�Fe3+��ԭΪFe2+ �� Ȼ��ʹFe3+���ڷ��ޣ�  ������ԳȺ�ɫ�����ñ�ɫ���ⶨ�������漰��Ӧ��4FeCl3+2NH2OHHCl�T4FeCl2+N2O��+6HCl+H2O
������ԳȺ�ɫ�����ñ�ɫ���ⶨ�������漰��Ӧ��4FeCl3+2NH2OHHCl�T4FeCl2+N2O��+6HCl+H2O
��1����̬Fe2+�ĺ�������Ų�ʽΪ��
��2���ǰ���NH2OH���е�����ԭ�ӵ��ӻ���ʽ����
��3���ǰ�����ɸ�Ԫ���У�Ԫ�صĵ�һ�����ܣ�I1���ɴ�С��˳��Ϊ ����Ԫ�ط��ű�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ͱ��Ӷ����ڷ�����
B.CCl4����CH4�Ƶã�����ȡ��ˮ�еĵ�
C.�������͡�TNT����������
D.ʯ����Ҫ�Ǹ�����������������ϩ����ɵĻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�������ķ����в���ȷ���ǣ�������
A.�Ӿƾ���ˮ�Ļ�����з�����ƾ�--����
B.ʹ���ǵ�ʳ��ˮ�����--���˷�
C.����ˮ�з������--����
D.��ˮ��NaCl--�����ᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.��NaClO��Һ��ͨ�����SO2���壺ClO��+H2O+SO2�THClO+HSO ![]()
B.��ϡ�������Һ��ȥ����Ʒ��������⣺Fe2O3+6H+�T2Fe3++3H2O
C.NaHCO3��������Ca��OH��2��Һ��Ӧ��Ca2++2OH��+2HCO ![]() �TCaCO3��+2H2O+CO
�TCaCO3��+2H2O+CO ![]()
D.10mL 0.5mol/L��������Һ��20mL 0.5mol/L Ba��OH��2��Һ��Ϸ�Ӧ��3Ba2++6OH��+2Al3++3SO ![]() �T3BaSO4��+2Al��OH��3��
�T3BaSO4��+2Al��OH��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ���Ũ������������̷�Ӧ����ȡ������������Ӧ�Ļ�ѧ����ʽΪ��MnO2��4HCl(Ũ)![]() MnCl2��Cl2����2H2O���Ƚ�һ�����Ķ��������ܽ���200mLŨ�����У�����Ӧ����8.96L(�����)Cl2ʱ�����ʣ����Һ�������Ũ��Ϊ2mol/L�����跴Ӧǰ����Һ��������䣩���ش��������⣺
MnCl2��Cl2����2H2O���Ƚ�һ�����Ķ��������ܽ���200mLŨ�����У�����Ӧ����8.96L(�����)Cl2ʱ�����ʣ����Һ�������Ũ��Ϊ2mol/L�����跴Ӧǰ����Һ��������䣩���ش��������⣺
��1�������ڷ�Ӧ�б��ֳ�������Ϊ___________________��
��2��д��������ȡCl2�����ӷ���ʽ��______________________________ ��
��3�����㷴Ӧ����MnO2������Ϊ_________g,��������HCl�����ʵ���Ϊ______ mol����ʼHCl�����ʵ���Ũ��Ϊ____________mol/L.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com