
【题目】下列能用于刻蚀玻璃的溶液是
A. 盐酸 B. 硫酸 C. 硝酸 D. 氢氟酸
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18 g/cm,其中镁离子的质量分数为5.1%。300 mL该溶液中Cl-的物质的量约为( )
A.0.37 mol B.0.63 mol C.0.74 mol D.1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池,则下列说法正确的是

A.图2电池放电过程中,Na+从正极区向负极区迁移
B.图2电池负极区的电极反应为BH4-― 8e- + 8OH-=BO2- + 6H2O
C.若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO2 ![]() 2NO + O2, 此反应达到平衡状态的标志是( )
2NO + O2, 此反应达到平衡状态的标志是( )
A. 单位时间内生成2n molNO同时生成2n molNO2
B. 单位时间内生成2n molNO同时生成n molO2
C. 混合气体中NO2、NO和O2的物质的量之比为2﹕2﹕1
D. 混合气体中NO2体积分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g)![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)1mol铁粉和1molCO2在2L密闭容器中反应,判断该反应达到平衡状态的依据是 (填序号)。
A.容器内压强不再改变
B.c(CO)不再改变
C.生成1mol的FeO
D.c(CO2)=c(CO)
E.v正(CO2)=v逆(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.4 mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K= (保留二位有效数字)。
(4)一定条件下,该反应在体积固定的密闭容器中进行一段时间后达到平衡状态。使该平衡状态正向移动的措施有(写出两条) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上可在碱性溶液中通过电解的方法实现由N2制取NH3:
2N2+6H2O![]() 4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
(2)有人设想寻求合适的催化剂和电极材料.以N2,H2为电极反应物;以HCl-NH4Cl为电解质榕液制取新型燃料电池。请写出该电池的正极反应式________________。
(3)电解原理在化学工业中有着广泛的应用。若用惰性电极电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体672mL(标准状况下)时,溶液的c(H+)=_____(假设电解后溶液体积不变)。
(4)铁、铝是现代金属材料的主角。
已知铝的燃烧热为1675kJ/mol,2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-822kJ/mol;
则2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氯气消毒的自来水配制下列溶液时,会使配制的溶液变质的是( )
①NaOH ②AgNO3 ③Na2CO3 ④ FeCl2
A.只有②④ B.只有④ C.只有② D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
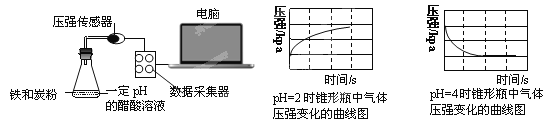
分析图像,以下结论错误的是
A.溶液pH≤2时,生铁发生析氢腐蚀
B.生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍
C.在酸性溶液中生铁可能发生吸氧腐蚀
D.两溶液中负极反应均为:Fe – 2e-===Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com