
����Ŀ���п��淴ӦFe��s��+CO2��g��![]() FeO��s�� + CO��g������֪���¶�938Kʱ��ƽ�ⳣ��K=1.5����1173Kʱ��K=2.2 ��
FeO��s�� + CO��g������֪���¶�938Kʱ��ƽ�ⳣ��K=1.5����1173Kʱ��K=2.2 ��
��1��1mol���ۺ�1molCO2��2L�ܱ������з�Ӧ���жϸ÷�Ӧ�ﵽƽ��״̬�������� �����������
A��������ѹǿ���ٸı�
B��c��CO�����ٸı�
C������1mol��FeO
D��c��CO2��=c��CO��
E��v����CO2��=v����CO��
��2���÷�Ӧ������Ӧ��_________��ѡ����ȡ��������ȡ�����Ӧ��
��3������ʼʱ��Fe��CO2��������̶����ܱ������У�CO2����ʼŨ��Ϊ2.4 mol/L��ij�¶�ʱ�ﵽƽ�⣬��ʱ������CO��Ũ��Ϊ1.0 mol/L������¶���������Ӧ��ƽ�ⳣ��K= ��������λ��Ч��������
��4��һ�������£��÷�Ӧ������̶����ܱ������н���һ��ʱ���ﵽƽ��״̬��ʹ��ƽ��״̬�����ƶ��Ĵ�ʩ����д�������� �� ��
���𰸡���1��BE��2��������3��0.71
��4�����߷�Ӧ�¶�������CO2Ũ������СCOŨ��
��������
�����������1��A.����������ʵ�������,���º�����,������ѹǿΪ��ֵ,��A������B.c��CO�����ֲ���,˵�����淴Ӧ�������,��Ӧ����ƽ��,����Bѡ������ȷ����D.ƽ��ʱCO2��COŨ���������̼��ת�����й�,��һ�����,��D����,E.v����CO2��=v����CO��ʱ,CO�����������������������,��Ӧ�ﵽ��ƽ��״̬,����Cѡ������ȷ��������BEѡ������ȷ����
��2���¶�����ƽ�ⳣ������,˵�������¶�ƽ�������ƶ�,����ӦΪ���ȷ�Ӧ,��ˣ�������ȷ����:������
��3��Fe��s��+CO2��g��![]() FeO��s�� + CO��g����ѧƽ�ⳣ������ʽ
FeO��s�� + CO��g����ѧƽ�ⳣ������ʽ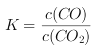 ,CO2����ʼŨ��Ϊ2.0 mol/L,ij�¶�ʱ�ﵽƽ��,��ʱ������CO��Ũ��1.0 mol/L,��ƽ��ʱCO2��Ũ��Ϊ1.0 mol/L,����¶���ƽ�ⳣ��K=1.0/1.0=1.0,��ˣ�������ȷ����1.0��
,CO2����ʼŨ��Ϊ2.0 mol/L,ij�¶�ʱ�ﵽƽ��,��ʱ������CO��Ũ��1.0 mol/L,��ƽ��ʱCO2��Ũ��Ϊ1.0 mol/L,����¶���ƽ�ⳣ��K=1.0/1.0=1.0,��ˣ�������ȷ����1.0��
��4��������ӦΪ���ȷ�Ӧ,�����¶�ƽ�������ƶ�,������̼���ʵ�����С,������������ʵ�������,������̼�����ʵ���������С������ͨ��CO,ƽ�ⳣ������,����������CO�������̼�����ʵ���֮�Ȳ���,��CO2�����ʵ�����������,��ˣ�������ȷ����:��С������.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����ʹ��ѧ��Ӧ���ʼӿ���ǣ� �� �����ӷ�Ӧ������ʵ���
�������¶�
�������������
�ܼ��������
A.�٢ڢ�
B.�ڢ�
C.�٢ڢ�
D.ֻ�Т�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A���ڳ�����SiO2(s)+2C(s)��Si(s)+2CO(g)�����Է����У���÷�Ӧ��H��0
B�������£�NH4Cl��Һ��ˮϡ�ͣ�![]() ����
����
C�����������Һ�еμӷ�̪����Һ��죬֤��Na2SiO3������ˮ��
D����ͼ�ɱ�ʾ������Һ��ͨ�백����������������Һ�����Եı仯
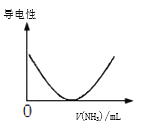
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A��NaCl��Һ�ڵ����������µ����Na+ B�����ӻ�����һ���ǵ����
C������ˮ����������ӵĻ����ﶼ���� D������������ˮ�����Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���ܽ�Al��OH��3 �� �����Һ�п��ܴ���������������ǣ� ��
A.Fe3+��NH4+��SCN����Cl��
B.K+��Na+��SO42����HCO3��
C.Na+��Ba2+��Cl����NO3��
D.A13+��Na+��A1O2����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£�44.8 L H2�����ʵ���Ϊ
A. 1.0 mol B. 2.0 mol C. 3.0 mol D. 4.0 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��֧�Թ��е���Һ�ֱ���б��еIJ�����ͨ���۲쵽��ʵ������ó��Ľ�����ȷ���ǣ� ��
���� | ���� | ���� | |
A | �ٵμ�ϡHNO3�ڵμ�BaCl2��Һ | �����������ɫ���� | ԭ��Һһ���� |
B | �μ�ϡ���� | �д������ݲ��� | ԭ��Һһ���� |
C | �ٵμ�ϡHCl�ڵμ�AgNO3��Һ | �����������ɫ���� | ԭ��Һһ����Cl�� |
D | �ٵμ�KCSN��Һ�ڵμ���ˮ | ������������Һ�ʺ�ɫ | ԭ��Һһ����Fe2�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�漰����ȼ�ϵ���������Ҫ�о�CO2��CO֮���ת����Ϊ��Ū������ɣ���һ������CO2������̼������ɱ���ܱ������з�Ӧ��C(s)��CO2(g)![]() 2CO(g) H�����ѹǿ���¶ȶ�CO��CO2��ƽ����ɵ�Ӱ����ͼ��ʾ��
2CO(g) H�����ѹǿ���¶ȶ�CO��CO2��ƽ����ɵ�Ӱ����ͼ��ʾ��

�ش��������⣺
��1��p1��p2��p3�Ĵ�С��ϵ��______________�������C��CO2��Ӧ��CO2��ƽ��ת���ʣ�Ӧ��ȡ�Ĵ�ʩΪ ��ͼ��a��b��c�����Ӧ��ƽ�ⳣ����С��ϵ��____________��
��2��900 ����1.013 MPaʱ��1 mol CO2������̼��Ӧ��ƽ������������ΪV��CO2��ת����Ϊ_________���÷�Ӧ��ƽ�ⳣ��K�� ��
��3����(2)��ƽ����ϵ�¶Ƚ���640 ����ѹǿ����0.1013 MPa�����´ﵽƽ���CO2���������Ϊ50%�������ı�ʱ������Ӧ���淴Ӧ������α仯��____________������֮���кι�ϵ��___________��
��4��һ�������£���CO2������̼��Ӧ����ƽ����ϵ�м���H2���ʵ������������з�Ӧ������
CO(g)��3H2(g)![]() CH4(g)��H2O(g) H1��-206.2 kJ/mol
CH4(g)��H2O(g) H1��-206.2 kJ/mol
CO(g)��H2O(g)![]() CO2(g)��H2(g) H2��-41.2 kJ/mol
CO2(g)��H2(g) H2��-41.2 kJ/mol
�� �������̼��������Ӧת��Ϊ�����ˮ�������Ȼ�ѧ����ʽ��_________________��
�� ��֪298 Kʱ��ػ�ѧ����������Ϊ��
��ѧ�� | H��H | O��H | C��H |
|
E/(kJ��mol-1) | 436 | 465 | 413 | 1076 |
����ݼ��ܼ��㣬H1�� ����������ʵ��ֵ����ϴ��ԭ������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com