
| A、N、O、F |
| B、N、P、As |
| C、K、Na、Li |
| D、Cl、O、H |


科目:高中化学 来源: 题型:
| A、该反应属于分解反应、氧化还原反应、放热反应 |
| B、该反应瞬间能产生大量高温气体,推动飞船飞行 |
| C、从能量变化上看,该反应是化学能转变为热能和动能 |
| D、反应中NH4ClO4只起到氧化剂的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a-n=b+m |
| B、a+m=b-n |
| C、氧化物为YOm |
| D、氢化物为HnY或YHn |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甘氨酸与氢氧化钠溶液反应: | ||
| B、软脂酸与氢氧化钠溶液反应:H++OH-=H2O | ||
C、二氧化碳通入苯酚钠溶液中:CO2+2C6H5O-+H2O→2C6H5OH+CO
| ||
| D、乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:
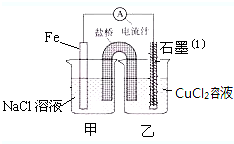 某实验小组的同学对电化学原理进行了一系列探究活动
某实验小组的同学对电化学原理进行了一系列探究活动查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | |
| A | 取待测液先进行焰色反应,再加足量稀盐酸,将产生气体通入品红溶液 | 火焰呈黄色,品红溶液褪色 | 原溶液一定是亚硫酸钠溶液 |
| B | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通过苯酚钠溶液 | 苯酚钠溶液中出现白色浑浊 | 不能说明酸性:醋酸>碳酸>苯酚 |
| C | 常温下向足量浓硫酸和稀硫酸中,分别加入相同质量、相同体积的铁片 | 相同时间两者产生H2速率不同 | 反应物的浓度越大,反应速率越快 |
| D | 相同的铝片分别与同温同体积,且c(H+)=1 mol?L-1盐酸、硫酸反应 | 铝与盐酸反应产色很难过气泡较快 | 可能是Cl-对该反应起到促进作用 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.| 1 |
| 2 |
| 1 |
| 2 |
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com