
【题目】在25mL0.1mol·L-1某一元碱中,逐滴加入0.1mol·L-1醋酸,滴定曲线如图所示。则下列说法正确的是( )

A.无法判断该碱溶液能否可以溶解Al(OH)3
B.a点对应的体积值等于25mL
C.C点时,c(CH3COO-)>c(Na+)>c(OH-) >c(H+)
D.D点时,c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
【答案】D
【解析】
A. 0.1mol·L-1某一元碱,其pH=13,则表明此碱为一元强碱,该碱溶液能溶解Al(OH)3,A错误;
B. 由A分析知,此碱为一元强碱,二者刚好完全反应时,溶液呈碱性,此时消耗醋酸25mL,要使溶液pH=7,醋酸需过量,从而得出其体积大于25mL,B错误;
C. C点时,碱不一定是NaOH溶液,所以溶液中不一定含有Na+,C错误;
D. D点时,溶液为等浓度的醋酸盐与醋酸的混合溶液,此时溶液中存在以下两个电离平衡:CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() H++OH-,从而得出c(CH3COO-)=c(CH3COOH)+2[c(H+)-c(OH-)],整理后可得出c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),D正确;
H++OH-,从而得出c(CH3COO-)=c(CH3COOH)+2[c(H+)-c(OH-)],整理后可得出c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),D正确;
故选D。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铜投入浓硝酸中:Cu + 2NO![]() + 2H+ = Cu2+ + 2NO↑+ H2O
+ 2H+ = Cu2+ + 2NO↑+ H2O
B.氧化铝投入稀盐酸中:Al2O3 + 6H+ =2Al3+ + 3H2O
C.钠和水反应:Na + H2O = Na+ + OH- + H2↑
D.用食醋溶解氢氧化镁:Mg(OH)2+2H+=Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向Ca(ClO)2溶液中通入少量CO2:2ClO+CO2+H2O2HClO+![]()
B. 向AgCl悬浊液中加入Na2S溶液,白色沉淀变成黑色:2AgCl+S2Ag2S+2Cl
C. 用强碱溶液吸收工业尾气制取硝酸:NO+NO2+2OH2![]() +H2O
+H2O
D. 向莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氢氧化钠溶液:![]() +Fe2++3OHNH3·H2O+Fe(OH)2↓
+Fe2++3OHNH3·H2O+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、发生的现象、解释或结论都正确的是![]()
选项 | 实验操作 | 发生现象 | 解释或结论 |
A | 向NaCl和KI的混合溶液中,逐滴加入 | 溶液中先产生白色沉淀,后产生黄色沉淀 |
|
B | 用玻璃棒蘸取氯水点到蓝色石蕊试纸上 | 试纸先变红后褪色 | 氯水中含有 |
C | 将铜片与芯片用导线连接后,插入稀硫酸中 | 铜片上有气泡产生 | 在锌的作用下,铜与硫酸反应产生氢气 |
D | 向某溶液中加入过量盐酸 | 产生能使澄清石灰水变浑浊的无色气体 | 该溶液为 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用硫和氮的氧化物是保护环境的重要举措。
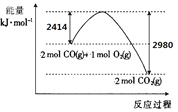
I.(1)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如图所示,则CO从燃煤烟气中脱硫的热化学方程式为______ (△H用含m的代数式表示) 。
(2)在模拟回收硫的实验中,向某恒容密闭容器中通入2.8molCO和1molSO2气体,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
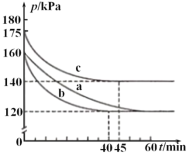
①与实验a相比,实验c改变的实验条件可能是_________。
②请利用体积分数计算该条件下实验b的平衡常数K=________。(列出计算式即可)(注:某物质的体积分数=该物质的物质的量/气体的总物质的量)
(3)双碱法除去SO2的原理为:NaOH溶液![]() Na2SO3溶液。该方法能高效除去SO2并获得石膏。
Na2SO3溶液。该方法能高效除去SO2并获得石膏。
①该过程中NaOH溶液的作用是_______。
②25℃时,将一定量的SO2通入到100mL0.1mol/L的NaOH溶液中,两者完全反应得到含Na2SO3、NaHSO3的混合溶液,溶液恰好呈中性,则溶液中H2SO3的物质的量浓度是____(假设反应前后溶液体积不变;25℃时,H2SO3的电离常数 K1=1.0×10-2 K2=5.0×10-8)。
II.用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
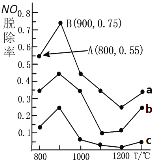
(1)曲线a中NH3的起始浓度为4×10-5mol/L,从A点到B点经过1秒,该时间段内NO的脱除速率为____mg/(L·s)。
(2)不论以何种比例混合,温度超过900℃,NO脱除率骤然下降,除了在高温条件下氮气与氧气发生反应生成NO,可能的原因还有(一条即可)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律分析下面的推断,其中错误的是![]()
A.铍![]() 的氧化物对应的水化物可能具有两性
的氧化物对应的水化物可能具有两性
B.砹![]() 为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于酸
为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于酸
C.硒化氢![]() 是无色、有毒且稳定性比硫化氢还差的气体
是无色、有毒且稳定性比硫化氢还差的气体
D.同一主族的元素从上到下,金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离能是衡量元素失电子能力的重要依据,随着元素核电荷数的递增,电离能值呈现周期性变化规律。根据所学知识,回答下列问题。
![]() 第一电离能指的是______。
第一电离能指的是______。
![]() 如图是部分元素原子的第一电离能
如图是部分元素原子的第一电离能![]() 随原子序数变化关系
随原子序数变化关系![]() 其中12号至17号元素的有关数据缺失
其中12号至17号元素的有关数据缺失![]() 。
。
![]() 根据图示变化规律,可推测S的第一电离能的大小
根据图示变化规律,可推测S的第一电离能的大小![]() 最小
最小![]() 范围为______
范围为______![]() ______
______![]() 填元素符号
填元素符号![]() 。
。
![]() 据图可知,同主族元素原子第一电离能
据图可知,同主族元素原子第一电离能![]() 变化规律是______。
变化规律是______。
![]() 图中第一电离能最小的元素在周期表中的位置______。
图中第一电离能最小的元素在周期表中的位置______。
![]() 根据对角线规则铍元素最高价氧化物的水化物应该具有______。
根据对角线规则铍元素最高价氧化物的水化物应该具有______。
![]() 用In表示元素的第n电离能,则图中的a、b、c分别代表______。
用In表示元素的第n电离能,则图中的a、b、c分别代表______。

A.a为![]() 、b为
、b为![]() 、c为
、c为![]()
B.a为![]() 、b为
、b为![]() 、c为
、c为![]()
C.a为![]() 、b为
、b为![]() 、c为
、c为![]() D.a为
D.a为![]() 、b为
、b为![]() 、c为
、c为![]()
![]() 铜、锌两种元素的第一电离能、第二电离能如表所示:
铜、锌两种元素的第一电离能、第二电离能如表所示:
电离能 |
|
|
Cu | 746 | 1958 |
Zn | 906 | 1733 |
铜的第一电离能![]() 小于锌的第一电离能,而铜的第二电离能
小于锌的第一电离能,而铜的第二电离能![]() 却大于锌的第二电离能,其主要原因是______。
却大于锌的第二电离能,其主要原因是______。
![]() 与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能
与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能![]() ,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能
,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能![]() ,部分元素或离子的电子亲和能数据如下表所示:
,部分元素或离子的电子亲和能数据如下表所示:
元素 | Cl | Br | I | O |
|
电子亲和能 | 349 | 343 | 295 | 141 |
|
![]() 下列说法中错误的是______。
下列说法中错误的是______。
A.元素的电子亲和能越大,越容易得到电子
B.一个基态的气态氧原子得到一个电子成为![]() 时放出141kJ的能量
时放出141kJ的能量
C.氧元素的第二电子亲和能是![]()
D.基态的气态氧原子得到两个电子成为![]() 需要吸收能量
需要吸收能量
![]() 图中数据显示,同主族元素
图中数据显示,同主族元素![]() 从上到下依次减小,其原因是_____。
从上到下依次减小,其原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700 ℃,催化剂”)。G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体。
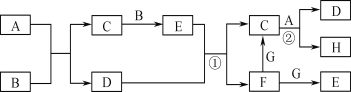
请回答下列问题:
(1)E的化学式为________________。
(2)A的电子式为________________。
(3)写出反应①的离子方程式:________________________________。
(4)写出反应②的化学方程式,并标出电子转移的方向与数目:
______________ __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com