
ЁОЬтФПЁПЛиЪеРћгУСђКЭЕЊЕФбѕЛЏЮяЪЧБЃЛЄЛЗОГЕФживЊОйДыЁЃ
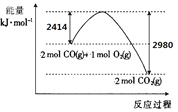
IЃЎЃЈ1ЃЉЙЄвЕЩњВњПЩРћгУCOДгШМУКбЬЦјжаЭбСђЁЃ
вбжЊS(s)ЕФШМЩеШШ(ЁїH)ЮЊ-mkJ/molЁЃCOгыO2ЗДгІЕФФмСПБфЛЏШчЭМЫљЪОЃЌдђCOДгШМУКбЬЦјжаЭбСђЕФШШЛЏбЇЗНГЬЪНЮЊ______ (ЁїHгУКЌmЕФДњЪ§ЪНБэЪО) ЁЃ
ЃЈ2ЃЉдкФЃФтЛиЪеСђЕФЪЕбщжаЃЌЯђФГКуШнУмБеШнЦїжаЭЈШы2.8molCOКЭ1molSO2ЦјЬхЃЌЗДгІдкВЛЭЌЬѕМўЯТНјааЃЌЗДгІЬхЯЕзмбЙЧПЫцЪБМфЕФБфЛЏШчЭМЫљЪОЁЃ
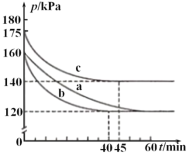
ЂйгыЪЕбщaЯрБШЃЌЪЕбщcИФБфЕФЪЕбщЬѕМўПЩФмЪЧ_________ЁЃ
ЂкЧыРћгУЬхЛ§ЗжЪ§МЦЫуИУЬѕМўЯТЪЕбщbЕФЦНКтГЃЪ§K=________ЁЃЃЈСаГіМЦЫуЪНМДПЩЃЉЃЈзЂЃКФГЮяжЪЕФЬхЛ§ЗжЪ§=ИУЮяжЪЕФЮяжЪЕФСП/ЦјЬхЕФзмЮяжЪЕФСПЃЉ
ЃЈ3ЃЉЫЋМюЗЈГ§ШЅSO2ЕФдРэЮЊЃКNaOHШмвК![]() Na2SO3ШмвКЁЃИУЗНЗЈФмИпаЇГ§ШЅSO2ВЂЛёЕУЪЏИрЁЃ
Na2SO3ШмвКЁЃИУЗНЗЈФмИпаЇГ§ШЅSO2ВЂЛёЕУЪЏИрЁЃ
ЂйИУЙ§ГЬжаNaOHШмвКЕФзїгУЪЧ_______ЁЃ
Ђк25ЁцЪБ,НЋвЛЖЈСПЕФSO2ЭЈШыЕН100mL0.1mol/LЕФNaOHШмвКжаЃЌСНепЭъШЋЗДгІЕУЕНКЌNa2SO3ЁЂNaHSO3ЕФЛьКЯШмвКЃЌШмвКЧЁКУГЪжаадЃЌдђШмвКжаH2SO3ЕФЮяжЪЕФСПХЈЖШЪЧ____ЃЈМйЩшЗДгІЧАКѓШмвКЬхЛ§ВЛБфЃЛ25ЁцЪБЃЌH2SO3ЕФЕчРыГЃЪ§ K1=1.0ЁС10-2 K2=5.0ЁС10-8)ЁЃ
IIЃЎгУNH3ЯћГ§NOЮлШОЕФЗДгІдРэЮЊЃК4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ЁїH= -1807.98kJ/mol ЁЃВЛЭЌЮТЖШЬѕМўЯТЃЌNH3гыNOЕФЮяжЪЕФСПжЎБШЗжБ№ЮЊ4:1ЁЂ3:1ЁЂ1:3ЃЌЕУЕНNOЭбГ§ТЪЧњЯпШчЭМЫљЪОЁЃ
5N2(g)+6H2O(l) ЁїH= -1807.98kJ/mol ЁЃВЛЭЌЮТЖШЬѕМўЯТЃЌNH3гыNOЕФЮяжЪЕФСПжЎБШЗжБ№ЮЊ4:1ЁЂ3:1ЁЂ1:3ЃЌЕУЕНNOЭбГ§ТЪЧњЯпШчЭМЫљЪОЁЃ
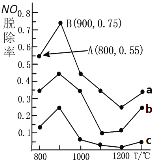
ЃЈ1ЃЉЧњЯпaжаNH3ЕФЦ№ЪМХЈЖШЮЊ4ЁС10-5mol/L,ДгAЕуЕНBЕуОЙ§1УыЃЌИУЪБМфЖЮФкNOЕФЭбГ§ЫйТЪЮЊ____mg/(LЁЄs)ЁЃ
ЃЈ2ЃЉВЛТлвдКЮжжБШР§ЛьКЯЃЌЮТЖШГЌЙ§900ЁцЃЌNOЭбГ§ТЪжшШЛЯТНЕЃЌГ§СЫдкИпЮТЬѕМўЯТЕЊЦјгыбѕЦјЗЂЩњЗДгІЩњГЩNOЃЌПЩФмЕФдвђЛЙгаЃЈвЛЬѕМДПЩЃЉ____ЁЃ
ЁОД№АИЁП2COЃЈgЃЉ+SO2ЃЈgЃЉ=SЃЈlЃЉ+2CO2ЃЈgЃЉЁїH=(m-566)kJЁЄmolЃ1 Щ§ЮТ 1.9ЁС1.9ЁС2.85/ЃЈ0.9ЁС0.9ЁС0.05ЃЉ ДпЛЏМС 5ЁС10-7mol/L 6ЁС10-2ЃЈЛђ0.06ЃЉ ИУЗДгІЕФе§ЗДгІЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏ
ЁОНтЮіЁП
IЃЎЃЈ1ЃЉИљОндзгЪиКуЃЌCOгыSO2ЗДгІЩњГЩSЃЈ1ЃЉКЭвЛжжЮоЖОЕФЦјЬхЪЧCO2ЃЌЛЏбЇЗНГЬЪНЮЊ2COЃЈgЃЉ+SO2ЃЈgЃЉ=SЃЈlЃЉ+2CO2ЃЈgЃЉЃЌРћгУЬтИјСНИіШШЛЏбЇЗНГЬЪННсКЯИЧЫЙЖЈТЩНјааЧѓЫуЁЃ
ЃЈ2ЃЉЂйaЁЂcПЊЪМОљЭЈШы2.8mol COКЭ1mol SO2ЃЌШнЦїЕФШнЛ§ЯрЭЌЃЌЖјЦ№ЪМЪБcЕФбЙЧПДѓгкaЃЌЮяжЪЕФСПгыЬхЛ§вЛЖЈЃЌбЙЧПгыЮТЖШГЪе§БШЙиЯЕЃЛ
ЂкЦјЬхбЙЧПжЎБШЕШгкЦјЬхЮяжЪЕФСПжЎБШЃЌНсКЯШ§ааЪНМЦЫуСаЪНЕУЕНВЮМгЗДгІЕФЖўбѕЛЏСђЮяжЪЕФСПЃЛдйМЦЫуИїЮяжЪЕФЬхЛ§ЗжЪ§ЃЌаДГіЦНКтГЃЪ§ЁЃ
ЃЈ3ЃЉЂйгУNaOHЮќЪеSO2ЃЌВЂгУCaOЪЙNaOHдйЩњЁЃ2NaOH+SO2=Na2SO3ЃЌNaOHдйЩњCaO+H2O+Na2SO3ЈTCaSO3+2NaOHЃЌДгЗДгІПЩвдПДГіNaOHзїДпЛЏМСЁЃ
ЂкИљОнЕчКЩЪиКуКЭЕчРыЗНГЬЪНЁЂЕчРыЦНКтГЃЪ§НтД№ЃЛ
IIЃЎЃЈ1ЃЉСНжжЗДгІЮяДцдкЕФЗДгІЃЌдіДѓвЛжжЗДгІЮяЕФСППЩЬсИпСэвЛжжЗДгІЮяЕФзЊЛЏТЪЃЌИљОнЭМЯѓЃЌЧњЯпaЕФNOЭбГ§ТЪзюИпЃЌМДNOЕФзЊЛЏТЪзюИпЃЌЫљвдNOЕФдкзмЗДгІЮяжаЕФБШР§зюЕЭЃЌNH3гыNOЕФЮяжЪЕФСПжЎБШЗжБ№ЮЊ4:1ЃЌИљОнNOЕФЭбГ§СПБфЛЏжЕКЭЭбГ§ЪБМфМЦЫуNOЕФЭбГіЫйТЪЃЛ
ЃЈ2ЃЉЖдЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЁЃ
IЃЎЃЈ1ЃЉИљОндзгЪиКуЃЌЩњГЩЕФЮоЖОЦјЬхЪЧЖўбѕЛЏЬМЃЌЗЂЩњЕФЗДгІЮЊ2COЃЈgЃЉ+SO2ЃЈgЃЉ=SЃЈlЃЉ+2CO2ЃЈgЃЉЁЃНЋЬтИјСНИіШШЛЏбЇЗНГЬЪНЂй2COЃЈgЃЉ+O2ЃЈgЃЉ=2CO2ЃЈgЃЉЁїH1=-566kJЁЄmolЃ1КЭЂкSЃЈlЃЉ+O2ЃЈgЃЉ=SO2ЃЈgЃЉЁїH2=-mkJЁЄmolЃ1ЃЌИљОнИЧЫЙЖЈТЩЂй-ЂкПЩЕУЫљЧѓЗДгІЕФШШЛЏбЇЗНГЬЪНЃЌМД2COЃЈgЃЉ+SO2ЃЈgЃЉ=SЃЈlЃЉ+2CO2ЃЈgЃЉЁїH=-566kJЁЄmolЃ1-ЃЈ-mkJЁЄmolЃ1ЃЉ=(m-566)kJЁЄmolЃ1ЁЃ
ЃЈ2ЃЉЂйaЁЂcПЊЪМОљЭЈШы2.8mol COКЭ1mol SO2ЃЌШнЦїЕФШнЛ§ЯрЭЌЃЌЖјЦ№ЪМЪБcЕФбЙЧПДѓгкaЃЌЮяжЪЕФСПгыЬхЛ§вЛЖЈЃЌбЙЧПгыЮТЖШГЪе§БШЙиЯЕЃЌЙЪcзщИФБфЕФЪЕбщЬѕМўПЩФмЪЧЃКЩ§ИпЮТЖШЃЛ
Ђк 2COЃЈgЃЉ+SO2ЃЈgЃЉ![]() 2CO2ЃЈgЃЉ+SЃЈlЃЉЃЌЩшЯћКФЖўбѕЛЏСђЮяжЪЕФСПxЃЌ
2CO2ЃЈgЃЉ+SЃЈlЃЉЃЌЩшЯћКФЖўбѕЛЏСђЮяжЪЕФСПxЃЌ
Ц№ЪМСПЃЈmolЃЉ 2.8 1 0
БфЛЏСПЃЈmolЃЉ 2x x 2x
ЦНКтСПЃЈmolЃЉ2.8-2x 1-x 2x
ЃЈ2.8+1ЃЉ/(2.8+1-x)=160/120
x=0.95molЃЌ
COЁЂSO2 ЁЂCO2 ЕФЬхЛ§ЗжЪ§ЗжБ№ЮЊ0.9/2.85ЁЂ0.05/2.85ЁЂ1.9/2.85
K=1.9ЁС1.9ЁС2.85/ЃЈ0.9ЁС0.9ЁС0.05ЃЉЁЃ
ЃЈ3ЃЉЂйгУNaOHЮќЪеSO2ЃЌВЂгУCaOЪЙNaOHдйЩњЁЃ2NaOH+SO2=Na2SO3ЃЌNaOHдйЩњCaO+H2O+Na2SO3ЈTCaSO3+2NaOHЃЌДгЗДгІПЩвдПДГіNaOHзїДпЛЏМСЁЃ
ЂкИљОнЕчКЩЪиКуЃКcЃЈNaЃЋЃЉ+cЃЈHЃЋЃЉ=cЃЈOHЃЃЉ+2cЃЈSO32ЃЃЉ+cЃЈHSO3ЃЃЉЃЌШмвКГЪжаадЃКcЃЈOHЃЃЉ=cЃЈHЃЋЃЉЃЌЕУcЃЈNaЃЋЃЉ=2cЃЈSO32ЃЃЉ+cЃЈHSO3ЃЃЉЃЌСюcЃЈHSO3ЃЃЉ=x,cЃЈSO32ЃЃЉ=(0.1-x)/2,ИљОнHSO3Ѓ![]() SO32Ѓ+HЃЋЃЌk2=5.0ЁС10-8=cЃЈSO32ЃЃЉcЃЈHЃЋЃЉ/cЃЈHSO3ЃЃЉЃЌ5.0ЁС108=10-7ЁС(0.1-x)/2x,ЕУx=0.05molЁЄLЃ1ЃЌcЃЈSO32ЃЃЉ=0.025molЁЄLЃ1ЃЌДњШыk1ЃЌH2SO3
SO32Ѓ+HЃЋЃЌk2=5.0ЁС10-8=cЃЈSO32ЃЃЉcЃЈHЃЋЃЉ/cЃЈHSO3ЃЃЉЃЌ5.0ЁС108=10-7ЁС(0.1-x)/2x,ЕУx=0.05molЁЄLЃ1ЃЌcЃЈSO32ЃЃЉ=0.025molЁЄLЃ1ЃЌДњШыk1ЃЌH2SO3![]() HSO3ЃЃЋHЃЋЃЌk1=1ЁС10-2=cЃЈHSO3ЃЃЉcЃЈHЃЋЃЉ/c(H2SO3)ЃЌc(H2SO3)=cЃЈHSO3ЃЃЉcЃЈHЃЋЃЉ/10-2=0.05ЁС10-7/10-2=5ЁС10-7molЁЄLЃ1.
HSO3ЃЃЋHЃЋЃЌk1=1ЁС10-2=cЃЈHSO3ЃЃЉcЃЈHЃЋЃЉ/c(H2SO3)ЃЌc(H2SO3)=cЃЈHSO3ЃЃЉcЃЈHЃЋЃЉ/10-2=0.05ЁС10-7/10-2=5ЁС10-7molЁЄLЃ1.
IIЃЎЃЈ1ЃЉЧњЯпaжаNH3ЕФЦ№ЪМХЈЖШЮЊ4ЁС10-5molЁЄLЃ1ЃЌМДNOЕФЦ№ЪМХЈЖШЮЊЃК1ЁС10-5molЁЄLЃ1ЃЌДгAЕуЕНBЕуОЙ§1УыЃЌИљОнЭМЯѓЃЌNOЕФЭбГ§ТЪДг55%ЩЯЩ§ЕН75%ЃЌдђИУЖЮЪБМфФкNOЕФЭбГ§СПЮЊЁїc=1ЁС10-5mol/LЁСЃЈ75%-55%ЃЉ=2ЁС10-6mol/LЃЌЪБМфМфИєЮЊЁїt=1sЃЌЫљвдИУЖЮЪБМфФкNOЕФЭбГ§ЫйТЪЮЊ=2ЁС10-6molЁЄLЃ1/1s=2ЁС10-6mol/(LЁЄsЃЉЃЌNOЪНСПЮЊ30ЃЌМД6ЁС10-2mg/(LЁЄsЃЉЃЛ
ЃЈ2ЃЉВЛТлвдКЮжжБШР§ЛьКЯЃЌЮТЖШГЌЙ§900ЁцЃЌNOЭбГ§ТЪжшШЛЯТНЕЃЌГ§СЫдкИпЮТЬѕМўЯТЕЊЦјгыбѕЦјЗЂЩњЗДгІЩњГЩNOЃЌПЩФмЕФдвђЛЙгаИУЗДгІЕФе§ЗДгІЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЮЊдЕчГизАжУЃЌЯТСаа№Ъіе§ШЗЕФЪЧ( )
A.аПЦЌШмНт
B.аПЦЌЮЊе§МЋ
C.ЭЦЌжЪСПМѕЩй
D.ИУзАжУНЋЕчФмзЊЛЏЮЊЛЏбЇФм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаРызгЗНГЬЪНжаЃЌЪєгкЫЎНтЗДгІЕФЪЧЃЈ ЃЉ
A.HCOOH+H2O![]() HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O![]() HCO3Ѓ+H+
HCO3Ѓ+H+
C.CO32-+ H2O![]() HCO3-+OH-
HCO3-+OH-
D.HS-+ H2O![]() S2-+H3O+
S2-+H3O+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯТСагаЙиШмвКЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.NaHCO3ШмвКМгЫЎЯЁЪЭЃЌc(Na+)гыc(HCO3-)ЕФБШжЕНЋМѕаЁ
B.pH=1ЕФвЛдЊЫсКЭpH=13ЕФвЛдЊМюЕШЬхЛ§ЛьКЯКѓШмвКВЛвЛЖЈГЪжаад
C.0.1mol/LСђЫсяЇШмвКжаЃК![]()
D.0.1mol/LЕФСђЛЏФЦШмвКжаЃК![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМИжжжїзхдЊЫи(Й§ЖЩдЊЫиТдШЅ)дкжмЦкБэжаЕФЮЛжУШчЯТ:
A | |||||||
M | B | D | |||||
E | G | R | J | ||||
T | |||||||
(1)EЁЂGЁЂTЕФдзгАыОЖгЩДѓЕНаЁЕФЫГађЪЧ_____(ЬюдЊЫиЗћКХ)ЁЃ
(2)ЮјдЊЫи(34Se)гыDЭЌжїзхЃЌЦфЗЧН№ЪєадБШD______(ЬюЁАЧПЁБЛђЁАШѕЁБ)ЁЃ
(3)EЁЂGдЊЫизюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяжЎМфФмЗДгІЃЌРызгЗНГЬЪНЮЊ:_______ЁЃ
(4)EЁЂDСНдЊЫиФмаЮГЩдзгИіЪ§БШ1:1 аЭЛЏКЯЮяЕФЕчзгЪНЮЊ________ЁЃ
(5)AгыMаЮГЩЕФЗжзгПЩФмЪЧ________(ЬюзжФИађКХ)ЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк25mL0.1molЁЄLЃ1ФГвЛдЊМюжаЃЌж№ЕЮМгШы0.1molЁЄLЃ1ДзЫсЃЌЕЮЖЈЧњЯпШчЭМЫљЪОЁЃдђЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A.ЮоЗЈХаЖЯИУМюШмвКФмЗёПЩвдШмНтAl(OH)3
B.aЕуЖдгІЕФЬхЛ§жЕЕШгк25mL
C.CЕуЪБЃЌc(CH3COOЃ)>c(Na+)>c(OHЃ) >c(H+)
D.DЕуЪБЃЌc(CH3COOЃ)+2c(OHЃ)=2c(H+)+c(CH3COOH)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкдЊЫижмЦкБэжаЕФФГаЉдЊЫижЎМфДцдкзХЬиЪтЕФЁАЖдНЧЯпЙиЯЕЁБЃЌР§ШчЃК![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЯрЫЦЕШЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
ЯрЫЦЕШЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ![]()
A.ЧтбѕЛЏюыЪЧСНадЧтбѕЛЏЮя
B.BЁЂSiЕФЕчИКадЪ§жЕЯрЫЦ
C.LiКЭMgЕФдзгАыОЖЯрНќЃЌЧвКЫЭтЕчзгХХВМЯрНќ
D.Liдк![]() жаШМЩеФмЩњГЩ
жаШМЩеФмЩњГЩ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЬѕМўЯТЃЌНЋMКЭNСНжжЦјЬхЭЈШы2 LУмБеШнЦїжаЃЌЗЂЩњЗДгІШчЯТЃКxM(g)ЃЋyN(g)![]() 2P(g)ЁЃ2sФкЕФЗДгІЫйТЪЃКv(M)ЃН1.5 molЁЄL-1ЁЄs-1ЃЌv(N)ЃН4.5 molЁЄL-1ЁЄs-1ЃЌv(P)ЃН3.0 molЁЄL-1ЁЄs-1ЁЃдђxЛ§yЕФжЕЗжБ№ЮЊ
2P(g)ЁЃ2sФкЕФЗДгІЫйТЪЃКv(M)ЃН1.5 molЁЄL-1ЁЄs-1ЃЌv(N)ЃН4.5 molЁЄL-1ЁЄs-1ЃЌv(P)ЃН3.0 molЁЄL-1ЁЄs-1ЁЃдђxЛ§yЕФжЕЗжБ№ЮЊ
A.2КЭ3B.3КЭ2C.3КЭ1D.1КЭ3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25 ЁцЪБЃЌЯђЕШХЈЖШЕФNaClКЭNa2CrO4ШмвКжаЗжБ№ЕЮМгAgNO3ШмвКЃЈвбжЊЃКAg2CrO4ЮЊзЉКьЩЋЃЉЃЌЦНКтЪБШмвКжаЯрЙиРызгХЈЖШЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)

A.L1ЮЊЯђNa2CrO4ШмвКжаЕЮМгAgNO3ШмвКЪБЕФРызгХЈЖШЙиЯЕЧњЯп
B.Ksp(AgCl)ЕФЪ§СПМЖЮЊ10-12
C.L1КЭL2НЛЕуДІЖдгІЕФСНжжШмвКжаc(Ag+)ЃНc(Cl-)ЃНc(CrO42-)
D.гУAgNO3БъзМШмвКВтЖЈШмвКжаCl-КЌСПЪБПЩгУNa2CrO4зіжИЪОМС
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com