
【题目】下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O![]() HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O![]() HCO3-+H+
HCO3-+H+
C.CO32-+ H2O![]() HCO3-+OH-
HCO3-+OH-
D.HS-+ H2O![]() S2-+H3O+
S2-+H3O+
科目:高中化学 来源: 题型:
【题目】下列有关溶液中微粒浓度关系的叙述错误的是
A.![]()
![]() 溶液中:
溶液中:![]()
B.pH相等的①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 四种溶液的物质的量浓度大小:①>②>③>④
四种溶液的物质的量浓度大小:①>②>③>④
C.室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合得溶液中:
的氨水等体积混合得溶液中:![]()
D.向![]()
![]() 溶液中滴加NaOH至溶液恰好呈中性:
溶液中滴加NaOH至溶液恰好呈中性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
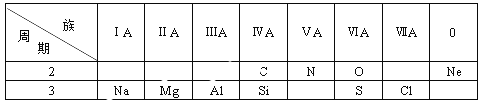
(1)金属性最强的元素是___________;
(2)最外层电子数为8的原子是___________;
(3) O和S二者原子半径较大的是___________;
(4)可用于制造光导纤维的氧化物是___________;
(5)CH4和SiH4二者热稳定性较强的是___________;
(6)MgO和Al2O3中,能与强碱溶液反应的是_____________;
(7)NaOH和Mg(OH)2中,碱性较弱的是___________;
(8)NO在空气中会变成红棕色的NO2,写出该反应的化学方程式___________;
(9)HClO4中氯元素的化合价是______;1mol HClO4含有_________mol O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答:

(1)反应物是__________;.
(2)2min内A的平均速率是________;
(3)写出化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各电解质溶液的分析正确的是( )
A.硫酸铁溶液中能大量共存的离子:K+、Na+、NO3-、CO32-
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.0.1molL﹣1Na2S溶液中存在:c(OH-)=c(H+)+c(HS﹣)+2c(H2S)
D.NH4HSO4溶液呈酸性的主要原因是:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向Ca(ClO)2溶液中通入少量CO2:2ClO+CO2+H2O2HClO+![]()
B. 向AgCl悬浊液中加入Na2S溶液,白色沉淀变成黑色:2AgCl+S2Ag2S+2Cl
C. 用强碱溶液吸收工业尾气制取硝酸:NO+NO2+2OH2![]() +H2O
+H2O
D. 向莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氢氧化钠溶液:![]() +Fe2++3OHNH3·H2O+Fe(OH)2↓
+Fe2++3OHNH3·H2O+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 有机化合物中每个碳原子最多形成4个共价键
B. 乙烯能使酸性高锰酸钾溶液和溴水褪色,但二者反应原理不相同
C. 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
D. 乙烯和苯均能发生氧化反应,说明乙烯和苯分子中均有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用硫和氮的氧化物是保护环境的重要举措。
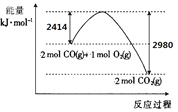
I.(1)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如图所示,则CO从燃煤烟气中脱硫的热化学方程式为______ (△H用含m的代数式表示) 。
(2)在模拟回收硫的实验中,向某恒容密闭容器中通入2.8molCO和1molSO2气体,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
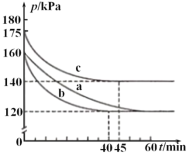
①与实验a相比,实验c改变的实验条件可能是_________。
②请利用体积分数计算该条件下实验b的平衡常数K=________。(列出计算式即可)(注:某物质的体积分数=该物质的物质的量/气体的总物质的量)
(3)双碱法除去SO2的原理为:NaOH溶液![]() Na2SO3溶液。该方法能高效除去SO2并获得石膏。
Na2SO3溶液。该方法能高效除去SO2并获得石膏。
①该过程中NaOH溶液的作用是_______。
②25℃时,将一定量的SO2通入到100mL0.1mol/L的NaOH溶液中,两者完全反应得到含Na2SO3、NaHSO3的混合溶液,溶液恰好呈中性,则溶液中H2SO3的物质的量浓度是____(假设反应前后溶液体积不变;25℃时,H2SO3的电离常数 K1=1.0×10-2 K2=5.0×10-8)。
II.用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
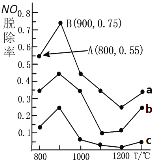
(1)曲线a中NH3的起始浓度为4×10-5mol/L,从A点到B点经过1秒,该时间段内NO的脱除速率为____mg/(L·s)。
(2)不论以何种比例混合,温度超过900℃,NO脱除率骤然下降,除了在高温条件下氮气与氧气发生反应生成NO,可能的原因还有(一条即可)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:

(1) 加入试剂B的目的是____________。
(2) 检验硫酸铵中含有铵根离子,常加入_____溶液加热检验,产生的气体常用____检验。
(3) 写出“除杂”反应的离子方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com