
【题目】下列有关溶液中微粒浓度关系的叙述错误的是
A.![]()
![]() 溶液中:
溶液中:![]()
B.pH相等的①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 四种溶液的物质的量浓度大小:①>②>③>④
四种溶液的物质的量浓度大小:①>②>③>④
C.室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合得溶液中:
的氨水等体积混合得溶液中:![]()
D.向![]()
![]() 溶液中滴加NaOH至溶液恰好呈中性:
溶液中滴加NaOH至溶液恰好呈中性:![]()
【答案】C
【解析】
A.![]()
![]() 溶液中,根据质子守恒可得:
溶液中,根据质子守恒可得:![]() ,选项A正确;
,选项A正确;
B.![]() 、
、![]() 、
、![]() 都是强碱弱酸盐,酸性越强,对应酸根离子的水解程度越弱,溶液pH越小,则对应酸根离子的水解程度大小为:
都是强碱弱酸盐,酸性越强,对应酸根离子的水解程度越弱,溶液pH越小,则对应酸根离子的水解程度大小为:![]() ,pH相等时溶液浓度大小为:
,pH相等时溶液浓度大小为:![]() ,即:
,即:![]() ;
;![]() 为强碱,则pH相等时氢氧化钠的浓度最小,所以四种溶液的物质的量浓度大小:
为强碱,则pH相等时氢氧化钠的浓度最小,所以四种溶液的物质的量浓度大小:![]() ,选项B正确;
,选项B正确;
C.室温下,pH=2的盐酸的浓度为0.01mol/L,pH=12的氨水的浓度一定大于0.01mol/L,等体积混合后氨水过量,溶液显示碱性,c(H+)<c(OH-),所得溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),因此溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-),选项C错误;
D.根据物料守恒可得:![]() ,则
,则![]() ;由于溶液为中性,则
;由于溶液为中性,则![]() ,根据电荷守恒可得:
,根据电荷守恒可得:![]()
![]() ,所以
,所以![]()
![]() ,结合
,结合![]() 可知:
可知:![]()
![]() ,所以溶液中离子浓度大小为:
,所以溶液中离子浓度大小为:![]() ,选项D正确。
,选项D正确。
答案选C。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、Q、T的原子序数与其常见化合价关系如图所示。下列说法正确的是( )
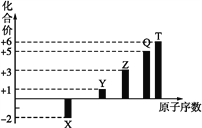
A. 1 mol TX2与足量X2反应生成TX3的分子数目为NA
B. Z元素形成的可溶性盐溶液可能显碱性
C. 1 mol Y2X2与足量H2O反应转移的电子数目为2NA
D. 0.1 mol Q元素的含氧酸在水中电离出的H+数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述不相符的是( )

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) >Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸>乙酸
C. 图丙用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,九种短周期元素![]() 用字母表示
用字母表示![]() 原子半径的相对大小、最高正价或最低负价的变化如图所示.
原子半径的相对大小、最高正价或最低负价的变化如图所示.

请回答下列问题;
![]() 、d、e、f四种元素的简单离子中,半径最大的离子是 ______
、d、e、f四种元素的简单离子中,半径最大的离子是 ______ ![]() 填离子符号
填离子符号![]()
![]() 的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
![]() 含f元素的两种离子在溶液中不能大量共存的原因是 ______
含f元素的两种离子在溶液中不能大量共存的原因是 ______ ![]() 用离子方程式表示
用离子方程式表示![]()
![]() 关于图乙所示转化关系
关于图乙所示转化关系![]() 代表卤素
代表卤素![]() ,下列说法错误的是 ______ 。
,下列说法错误的是 ______ 。
A.![]()
B.![]()
C.y、z的非金属性依次减弱,所以途径Ⅱ的热量按y、z的顺序依次增多
D.途径Ⅰ生成y的氢化物比生成z的氢化物更容易
![]() 元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:
元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:![]() 制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
A.钠与水反应制氢气 ![]() 过氧化钠与水反应制氧气
过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸 ![]() 氟单质与水反应制氧气
氟单质与水反应制氧气
![]() ,f的最高价氧化物的水化物的
,f的最高价氧化物的水化物的![]() ,使含
,使含![]() 的离子的溶液开始产生沉淀的pH为 ______ 。
的离子的溶液开始产生沉淀的pH为 ______ 。
![]() 元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知
时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知![]() 时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
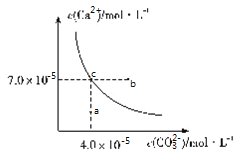
A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B.图中b点碳酸钙的结晶速率小于其溶解速率
C.通过蒸发,可使溶液由a点变化到c点
D.在25℃时,反应![]() 的平衡常数K=3500
的平衡常数K=3500
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )

A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。试回答下列问题:

(1)图中甲池通入O2极的电极反应式为____,通入CH3OH电极的电极反应式为______ 。
(2)若丙池中为饱和的MgCl2溶液,丙池中反应的离子方程式为__________。
(3)若c极的Pt电极换为Fe盐溶液为饱和食盐水,丙池中主要反应的离子方程式为___。
(4)若丙池装有1L 0.2 mol·L-1 CuSO4溶液,刚开始时,电极c的电极反应式为_______;电解一段时间后,向电解后的溶液中加入0.2mol碱式碳酸铜可使丙池恢复到原来的状态,则电路中转移电子的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O![]() HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O![]() HCO3-+H+
HCO3-+H+
C.CO32-+ H2O![]() HCO3-+OH-
HCO3-+OH-
D.HS-+ H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com