
【题目】25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(已知:Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )

A.L1为向Na2CrO4溶液中滴加AgNO3溶液时的离子浓度关系曲线
B.Ksp(AgCl)的数量级为10-12
C.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
D.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4做指示剂
【答案】D
【解析】
A. 25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液,随着Ag+浓度的增大,Cl-和CrO42-离子浓度降低,因为Ag+与Cl-1:1结合,而Ag+与CrO42-2:1结合,所以滴加硝酸银时,对氯化钠溶液中Cl-浓度影响幅度较大,分析图像中曲线的变化趋势知,L1为向NaCl溶液中滴加AgNO3溶液时的离子浓度关系曲线,故A错误;
B. 曲线L1可知,当Cl-浓度为10-4.5mol/L时,Ag+浓度近似为10-5mol/L,所以Ksp(AgCl)的数量级为10-10,故B错误;
C. 由图示L1和L2曲线的变化趋势知, L1和L2交点,c(Ag+)大于10-5mol/L,而c(Cl-)、c(CrO42-)小于10-5mol/L,所以它们不可能相等,故C错误;
D. 由题给信息可知,用硝酸银溶液滴定Cl-时,用Na2CrO4做指示剂,氯化银先沉淀,当溶液中出现砖红色Ag2CrO4时,表面Cl-已被定量沉淀,故D正确。
故选D。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】回收利用硫和氮的氧化物是保护环境的重要举措。
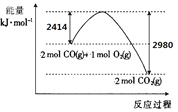
I.(1)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如图所示,则CO从燃煤烟气中脱硫的热化学方程式为______ (△H用含m的代数式表示) 。
(2)在模拟回收硫的实验中,向某恒容密闭容器中通入2.8molCO和1molSO2气体,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
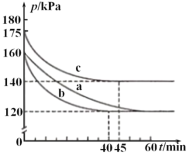
①与实验a相比,实验c改变的实验条件可能是_________。
②请利用体积分数计算该条件下实验b的平衡常数K=________。(列出计算式即可)(注:某物质的体积分数=该物质的物质的量/气体的总物质的量)
(3)双碱法除去SO2的原理为:NaOH溶液![]() Na2SO3溶液。该方法能高效除去SO2并获得石膏。
Na2SO3溶液。该方法能高效除去SO2并获得石膏。
①该过程中NaOH溶液的作用是_______。
②25℃时,将一定量的SO2通入到100mL0.1mol/L的NaOH溶液中,两者完全反应得到含Na2SO3、NaHSO3的混合溶液,溶液恰好呈中性,则溶液中H2SO3的物质的量浓度是____(假设反应前后溶液体积不变;25℃时,H2SO3的电离常数 K1=1.0×10-2 K2=5.0×10-8)。
II.用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
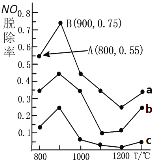
(1)曲线a中NH3的起始浓度为4×10-5mol/L,从A点到B点经过1秒,该时间段内NO的脱除速率为____mg/(L·s)。
(2)不论以何种比例混合,温度超过900℃,NO脱除率骤然下降,除了在高温条件下氮气与氧气发生反应生成NO,可能的原因还有(一条即可)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:

(1) 加入试剂B的目的是____________。
(2) 检验硫酸铵中含有铵根离子,常加入_____溶液加热检验,产生的气体常用____检验。
(3) 写出“除杂”反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
元素符号 | 元素性质或原子结构 |
T | 其一种无色氧化物遇空气变为红棕色 |
W | 其单质和化合物的焰色反应焰色均呈黄色 |
X | 基态原子的最外层电子排布式为 |
Y | 单质常温下为气体,可用于自来水消毒 |
Z | 一种核素的质量数为56,中子数为30 |
(1)Z元素位于周期表中第_ ______ 族,其基态原子的价层电子排布式为:______ ;
(2)T的一种化合物为![]() ,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
(3)W、X和Y三种元素中,第一电离能最小的为 ______ (填元素符号);W、X和Y的简单离子的半径从小到大的顺序为 ______ (用离子符号表示)。
(4)Z与水蒸气反应的化学方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y(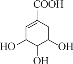 )是由中草药五倍子制备而成。
)是由中草药五倍子制备而成。
(1) Y属于_____填“无机化合物”或“有机化合物”)。
(2) Y中含氧官能团有羧基和_____(填名称)。
(3) 向Y溶液中滴入溴水,溴水褪色,说明Y中含有_____。
(4) Y具有还原性。向Y溶液中滴入几滴酸性KMnO4稀溶液,实验现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硫技术可用于处理废气中的氮氧化物。发生的化学反应为:2NH3(g)+NO(g)![]() 2N2(g)+3H2O(g) ΔH<0在恒容密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g) ΔH<0在恒容密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度平衡向正反应方向移动
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )

A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
D.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com