
| A. | 1L 0.3mol•L-1的Na2SO4溶液 | B. | 4L 0.5mol•L-1的NaCl溶液 | ||
| C. | 2L 0.3mol•L-1的NaOH的溶液 | D. | 1L 0.15mol•L-1的Na3PO4的溶液 |
分析 根据碳酸钠化学式可知,碳酸钠溶液中钠离子的浓度为碳酸钠溶液浓度的2倍,所以0.3mol•L-1 Na2CO3 溶液中Na+的钠离子浓度为0.6mol/L.根据选项中各溶质的化学式计算钠离子浓度,进行判断.
注意离子的浓度与物质的浓度有关,而与溶液的体积无关.
解答 解:0.3mol•L-1 Na2CO3 溶液中Na+的钠离子浓度为0.6mol/L.
A、0.3mol•L-1的Na2SO4溶液中钠离子浓度为0.3mol/L×2=0.6mol/L,故A正确;
B、0.5mol•L-1的NaCl溶液中钠离子浓度为0.5mol/L,故B错误;
C、0.3mol•L-1的NaOH溶液中钠离子浓度为0.3mol/L,故C错误;
D、0.15mol•L-1的Na3PO4溶液中钠离子的浓度为0.15mol/L×3=0.45mol/L,故D错误.
故选:A.
点评 本题考查物质的量浓度的计算,明确浓度与物质的构成的关系是解答本题的关键,并注意离子的浓度与物质的浓度有关,而与溶液的体积无关.


科目:高中化学 来源: 题型:解答题
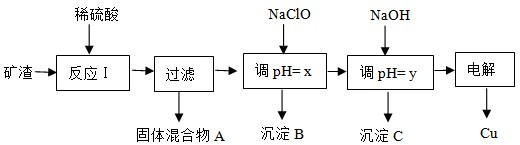
| 沉淀 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | KCl+AgNO3═KNO3+AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 用托盘天平称取5.20g氯化钠 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mo1 O2的同时生成n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n molNO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的平均密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能为电解池反应,Fe做阴极,CuSO4溶液做电解液 | |
| B. | 可能为原电池反应,负极Fe被还原为Fe2+ | |
| C. | 可能为电解池反应,阳极反应:Fe-2e-═Fe2+ | |
| D. | 可能为原电池反应,Fe做负极,Zn做正极,CuSO4溶液为电解液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com