
A、(
| ||
B、(
| ||
C、(
| ||
D、(
|
科目:高中化学 来源: 题型:
| A、将铜片放入稀硫酸中,无现象.若再向所得的溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 |
| B、在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| C、将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D、两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由极性键构成的极性分子 |
| B、由极性键构成的非极性分子 |
| C、由非极性键构成的极性分子 |
| D、中心原子采用sp2杂化的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,等体积的CH4和CO2所含共用电子对数相等 |
| B、与NaOH溶液、H2SO4溶液反应产生等量H2,所需铝粉质量相等 |
| C、1 mol OH-和17 g NH3所含电子数相等 |
| D、明矾溶液中K+和Al3+物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18 g/mol |
| B、CH4的摩尔质量为16 g |
| C、3.01×1023个SO2分子的质量为32 g |
| D、2mol NaOH溶于1 L水中配成溶液的浓度为2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、试剂瓶玻璃塞被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O |
| C、向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HD、NaOH都属于化合物 |
| B、碳素钢、不锈钢和目前流通的硬币都属于合金 |
| C、浓盐酸、浓硫酸、浓硝酸都属于氧化性酸 |
| D、氨水、醋酸、氢氧化铝都属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
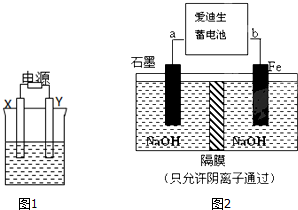 (Ⅰ)如图1,X和Y均为石墨电极:
(Ⅰ)如图1,X和Y均为石墨电极:| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
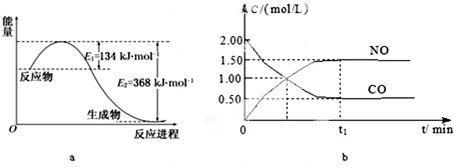
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol NO2 1mol CO | 2mol NO 2mol CO2 | 1mol NO2、1mol CO 1mol NO、1mol CO2 |
| 平衡时c(NO)/mol?L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
| b |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com