
【题目】下表列出了a~z15种元素在周期表中的位置:
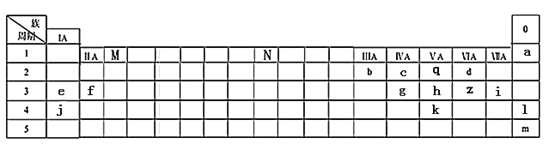
(1)元素b为___________(填名称);画出g的原子结构示意图_____________。
(2)写出M、N分别表示的族序数为_________、___________。元素f、i、j的原子分别形成简单离子后,离子半径从大到小的顺序是_______________(用离子符号表示)。元素l、m原子序数之差为_____。
(3)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________,该化合物中化学键有__________,该化合物可与z的一种氧化物发生化合反应,写出该反应的化学方程式为______________________________________________。
(4)根据元素周期表推测k元素及其化合物的性质正确的是_________
A.气态氢化物的稳定性:k>h>q B.k所在的主族元素通常用于制造农药和半导体材料
C.k的最高正价为+6 D.氢化物的沸点:q>k
(5)f与q形成的离子化合物可以与d的氢化物发生反应,写出该反应的化学方程式为_______________。
【答案】硼 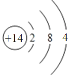 ⅢB Ⅷ Cl->K+>Mg2+ 18
ⅢB Ⅷ Cl->K+>Mg2+ 18  离子键、(非极性)共价键 Na2O2+SO2=Na2SO4 D Mg3N2+6H2O=3Mg(OH)2+2NH3↑
离子键、(非极性)共价键 Na2O2+SO2=Na2SO4 D Mg3N2+6H2O=3Mg(OH)2+2NH3↑
【解析】
根据元素在周期表中的位置判断元素的种类,根据元素周期律及元素性质分析解答。
(1)元素b为硼;g是Si,原子序数是14,原子结构示意图为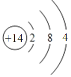 ,故答案为:硼;
,故答案为:硼; ;
;
(2)如图所示,M在ⅢB 族,N在Ⅷ族;同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则元素f、i、j的原子半径从大到小的顺序是K>Mg>Cl;核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则这三种原子分别形成简单离子后,离子半径从大到小的顺序是Cl->K+>Mg2+,故答案为:ⅢB; Ⅷ; Cl->K+>Mg2+
(3)元素O和Na形成的一种化合物为淡黄色固体,为过氧化钠,过氧化钠的电子式为 ,其中化学键有离子键、(非极性)共价键,该化合物与SO2反应的化学方程式为Na2O2+SO2=Na2SO4,故答案为:
,其中化学键有离子键、(非极性)共价键,该化合物与SO2反应的化学方程式为Na2O2+SO2=Na2SO4,故答案为:  ; 离子键、(非极性)共价键;Na2O2+SO2=Na2SO4;
; 离子键、(非极性)共价键;Na2O2+SO2=Na2SO4;
(4)A.同主族从上到下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则气态氢化物的稳定性:k<h<q,A错误;
B.k所在的主族即第ⅤA元素通常用于制造农药,但一般不能制作半导体材料,B错误;
C.As的最高正价为+5价,C错误;
D.氨气分子间存在氢键,则As的氢化物的沸点比NH3低,D正确;故答案为:D。
(5)氮化镁与水反应生成氢氧化镁和氨气,反应方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。


科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是( )
A.SO2氧化SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
B.500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
C.H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硝酸与金属发生反应时,随着硝酸浓度的下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是![]() 、NO、
、NO、![]() 、
、![]() 或
或![]() 中的一种或几种。某同学取一定量的铝铁合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
中的一种或几种。某同学取一定量的铝铁合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入![]() 溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
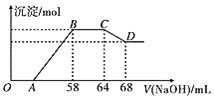
![]() 写出合金中铁与该稀硝酸反应的离子方程式:___________。
写出合金中铁与该稀硝酸反应的离子方程式:___________。
![]() 合金中铝的物质的量为__________mol,铁的物质的量为__________mol。
合金中铝的物质的量为__________mol,铁的物质的量为__________mol。
![]() 点对应的沉淀的物质的量为__________mol。
点对应的沉淀的物质的量为__________mol。
![]() 点对应的氢氧化钠溶液的体积为__________mL。
点对应的氢氧化钠溶液的体积为__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是
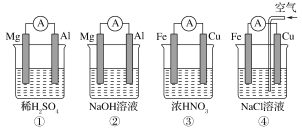
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,正极反应式为6H2O+6e-==6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-==Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-==H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G的一种合成路线如下:
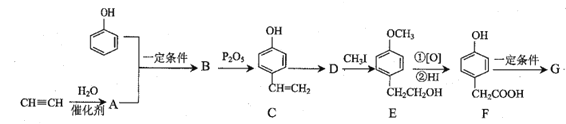
已知:①![]() +RCHO
+RCHO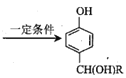 ;
;
②D溶液显酸性
③浓硫酸能与酚类物质发生取代反应,在苯环上引入-SO2H
回答下列问题:
(1)E分子中的含氧官能团名称为__。
(2)下列关于化合物B的说法不正确的是__(填标号)。
①苯环上一氯代物有2种
②分子式为C8H10O2
③既能与FeCl3溶液发生显色反应又能与溴水发生加成反应
④1mol化合物B与足量金属钠反应生成标准状况下氢气22.4L
(3)A→B的反应类型是__,D→E的目的是__,A的化学名称为__。
(4)写出F→G的化学方程式__。
(5)某烃的含氧衍生物X符合下列条件的同分异构体有种__(不含立体异构)。
①氧原子数与B相同但相对分子质量比B少36
②能发生水解反应
其中核磁共振氢谱只有2组峰的是__(写结构简式)
(6)写出用苯酚、![]() 为原料(其他无机试剂任选)制备化合物
为原料(其他无机试剂任选)制备化合物![]() 的合成路线。__。
的合成路线。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O![]() 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
![]()
(1)绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为__。
(2)若处理后的废水中c(Cr3+)=3.0×10-6mol/L,则废水中c(Fe3+)=__mol/L。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com