
【题目】含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O![]() 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
![]()
(1)绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为__。
(2)若处理后的废水中c(Cr3+)=3.0×10-6mol/L,则废水中c(Fe3+)=__mol/L。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是___杂化,CB3分子的空间构型为___。
(2)C的氢化物极易溶于水的原因是___。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:___(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了a~z15种元素在周期表中的位置:
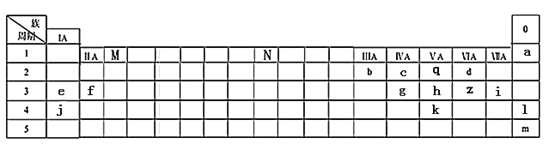
(1)元素b为___________(填名称);画出g的原子结构示意图_____________。
(2)写出M、N分别表示的族序数为_________、___________。元素f、i、j的原子分别形成简单离子后,离子半径从大到小的顺序是_______________(用离子符号表示)。元素l、m原子序数之差为_____。
(3)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________,该化合物中化学键有__________,该化合物可与z的一种氧化物发生化合反应,写出该反应的化学方程式为______________________________________________。
(4)根据元素周期表推测k元素及其化合物的性质正确的是_________
A.气态氢化物的稳定性:k>h>q B.k所在的主族元素通常用于制造农药和半导体材料
C.k的最高正价为+6 D.氢化物的沸点:q>k
(5)f与q形成的离子化合物可以与d的氢化物发生反应,写出该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期主族元素,且原子序数依次增大,X与W同主族,Z与R同主族,X的原子半径比Y的小,Y的最高价氧化物对应的水化物是强酸,Z的最外层电子数是其内层电子数的3倍。下列说法正确的是
A. 原子半径:r(W)>r(Z)>r(Y)
B. 简单气态氢化物的热稳定性:Y>Z
C. R的氧化物对应的水化物均为强酸
D. W2Z2与X2R均含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是
A.NaOH溶液B.CH3COOHC.稀HNO3D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )
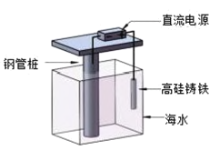
A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.抗坏血酸分子的结构为 ,分子中碳原子的杂化方式为sp2和sp3
,分子中碳原子的杂化方式为sp2和sp3
B.氯化铝在177.8℃时升华,因此AlCl3为分子晶体,是非电解质
C.碳元素和硅元素同主族,因此CO2和SiO2互为等电子体
D.一种磁性材料的单晶胞结构如图所示。该晶胞中碳原子的原子坐标为(![]() ,
,![]() ,
,![]() )
)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
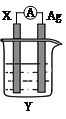
请回答下列问题:
(1) 电极X的材料是______;电解质溶液Y是________;
(2) 银电极为电池的__________极,发生的电极反应式为____________;X电极上发生的电极反应为______反应;(填“氧化”或“还原”)
(3) 外电路中的电子_________(填“流出”或“流向”)Ag电极。
(4) 当有1.6 g铜溶解时,银棒增重______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com