
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是___杂化,CB3分子的空间构型为___。
(2)C的氢化物极易溶于水的原因是___。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:___(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为___。
【答案】sp3杂化 三角锥形 氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,故氨气极易溶于水 Cl>P>S ![]()
【解析】
B原子得一个电子后3p轨道全满,则B的基态原子电子排布为1s22s22p63s23p5,B应该是氯元素。又因为A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,所以A是钠元素。C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以C是氮元素。D的最高化合价和最低化合价的代数和为4,则D是第ⅥA族元素。最高价氧化物中含D的质量分数为40%,则有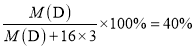 ,解得:M(D)=32。且其核内质子数等于中子数,所以D是16号元素S元素。据此分析。
,解得:M(D)=32。且其核内质子数等于中子数,所以D是16号元素S元素。据此分析。
(1)由分析可知,CB3分子为NCl3分子,N原子有一对孤对电子,与Cl原子成3个σ键,N原子轨道发生sp3杂化,所以NCl3分子的VSEPR模型为四面体形,忽略孤电子对,NCl3分子的空间构型为三角锥形;答案为:sp3杂化;三角锥形;
(2) C的氢化物为氨气,氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,故氨气极易溶于水。答案为:氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,故氨气极易溶于水;
(3)D元素为S元素,其同周期相邻元素分别为P、Cl,根据同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:Cl>P>S;答案为:Cl>P>S;
(4)基态氧原子共有6个价电子,根据核外电子排布规律可知,氧原子的价层电子的轨道表示式为![]() ;答案为:
;答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高炉炼铁中常见的反应为![]()
![]() 某实验小组在实验室模拟上述反应。一定温度下,在
某实验小组在实验室模拟上述反应。一定温度下,在![]() 盛有
盛有![]() 粉末的恒容密闭容器中通入
粉末的恒容密闭容器中通入![]() ,5min时生成
,5min时生成![]() 内用CO表示的平均反应速率是______
内用CO表示的平均反应速率是______![]() ;5min时CO的转化率为______;若将此时反应体系中的混合气体通入
;5min时CO的转化率为______;若将此时反应体系中的混合气体通入![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______。
![]() 上述反应的平衡常数表达式
上述反应的平衡常数表达式![]() ______;判断该反应已经达到平衡状态的依据是______
______;判断该反应已经达到平衡状态的依据是______![]() 填序号
填序号![]() 。
。
![]() 容器内固体质量保持不变
容器内固体质量保持不变 ![]() 容器中气体压强保持不变
容器中气体压强保持不变
![]()
![]()
![]() 已知上述反应的平衡常数K与温度
已知上述反应的平衡常数K与温度![]() 单位:
单位:![]() 之间的关系如图所示。
之间的关系如图所示。
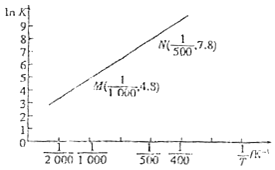
根据图象可知,该反应的平衡常随温度升高而______![]() 填“增大”“减小”或“不变
填“增大”“减小”或“不变![]() 。
。
![]() 结合上述有关信息,指出两条提高CO的平衡转化率的措施:______
结合上述有关信息,指出两条提高CO的平衡转化率的措施:______![]() 写两条
写两条![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液![]() ,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解
,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解![]() 。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示
。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示![]() 已知硝酸只被还原为NO气体
已知硝酸只被还原为NO气体![]() 。下列分析或结果错误的是
。下列分析或结果错误的是![]()
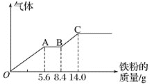
A.原混合酸中![]() 物质的量为
物质的量为![]()
B.OA段产生的是NO,AB段的反应为![]() ,BC段产生氢气
,BC段产生氢气
C.第二份溶液中最终溶质为![]()
D.![]() 浓度为
浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪90年代提出的“绿色化学”为有机合成指明了方向。我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反应过程示意图如图:
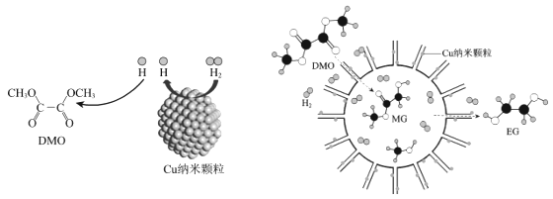
(1)MG分子中含有官能团的名称___;
(2)EG的分子式___;
(3)DMO酸性条件下水解的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA 与 2molB 发生反应 A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
A. 充分反应后,放出热量为 b kJ
B. 若 x=1,容器中压强不变时不能判断反应达到平衡
C. 当 B 和 D 的物质的量为 1:1 时,表明该反应已达到平衡
D. 达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是( )
A.SO2氧化SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
B.500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
C.H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O![]() 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
![]()
(1)绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为__。
(2)若处理后的废水中c(Cr3+)=3.0×10-6mol/L,则废水中c(Fe3+)=__mol/L。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com