
����Ŀ������������ԭ��Ӧ��2Ag��(aq)��Cu(s)��Cu2��(aq)��2Ag(s)��Ƶ�ԭ�����ͼ��ʾ��
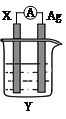
��ش��������⣺
��1�� �缫X�IJ�����______���������ҺY��________��
��2�� ���缫Ϊ��ص�__________���������ĵ缫��ӦʽΪ____________��X�缫�Ϸ����ĵ缫��ӦΪ______��Ӧ��������������������ԭ����
��3�� ���·�еĵ���_________������������������������Ag�缫��
��4�� ����1.6 gͭ�ܽ�ʱ����������______ g��
���𰸡�Cu AgNO3 �� Ag++e��=Ag ������Ӧ ���� 5.4
��������
��1�������ܷ�Ӧ����ʽ��Cu�Ļ��ϼ����ߣ�Ag�����ϼ۽��ͣ�����ԭ��صĹ���������XΪCu��YΪAgNO3��
(2)�����������������������������ĵ缫��ӦʽΪ��Ag����e��=Ag��X�缫�ϵķ�ӦʽΪCu��2e��=Cu2�������ϼ����ߣ�������������������Ӧ��
��3������ԭ��صĹ���ԭ�������ӴӸ��������·��������������ͭ�����·��ͭ��
��4��������Cu��2e��=Cu2����������Ag����e��=Ag�����ݵ�ʧ������Ŀ�غ㣬n(Cu)=1.6/64mol=0.025mol��ʧȥ���ӵ����ʵ���Ϊ0.025��2mol=0.05mol���������m(Ag)=108��0.05g=5.4g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��C(s)+CO2(g)![]() 2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��

��֪�������ѹ��P����=������ѹ��P�������������������˵����ȷ����
A. 550��ʱ��������������壬������ ����С��ƽ�ⲻ�ƶ�
B. 650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ25.0%
C. T��ʱ��������������CO2��CO��ƽ�����淴Ӧ�����ƶ�
D. 925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP=24.0P��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cr2O![]() �ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10-3mol/L��Cr2O
�ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10-3mol/L��Cr2O![]() ��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
![]()
��1���̷���ѧʽΪFeSO4��7H2O����Ӧ(I)�����ӷ���ʽΪ__��
��2����������ķ�ˮ��c(Cr3+)=3.0��10-6mol/L�����ˮ��c(Fe3+)=__mol/L��(Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ײ���MFe2Ox(3<x<4)��M��ʾ+2�۵Ľ���Ԫ�أ��ڷ�Ӧ�л��ϼ۲��仯�������£�MFe2Ox��ʹ��ҵ�����е�SO2ת��ΪS��ת�����̱�ʾ��ͼ������˵����ȷ���� �� ��
![]()
A.x��yB.SO2�Ǹ÷�Ӧ�Ĵ���
C.MFe2Ox�ǻ�ԭ��D.SO2�����˷ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������NH3����Ρ�N2H4��N2O4������ѧ��ѧ��������ҵ������������ռ����Ҫ��λ��
(1)���亽����������(N2H4)��N2O4��ȼ������ȼ������(N2H4)��N2O4�ķ�ӦΪ
2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) ��H=-1077 kJ��mol-1��
��֪��ط�Ӧ�Ļ�ѧ�������������±���ʾ��
��ѧ�� | N��H | N��N |
| O��H |
E/(kJ��mol��1) | 390 | 190 | 946 | 460 |
��ʹ1 mol N2O4(g)�����л�ѧ����ȫ����ʱ��Ҫ���յ�������________________��
��������˵��2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) ��H ��ƽ��״̬����________
a.��������ƽ����Է����������� b.V��N2��=3V�� N2O4��
c.N2H4���������ֲ��� d. ��H���ٱ仯
(2)N2O4��NO2֮����ڷ�ӦN2O4(g) ![]() 2NO2(g)����һ������N2O4���˺����ܱ������У������ƽ��ת����[��(N2O4)]���¶ȵı仯����ͼ��ʾ��
2NO2(g)����һ������N2O4���˺����ܱ������У������ƽ��ת����[��(N2O4)]���¶ȵı仯����ͼ��ʾ��

����ͼ�Ʋ�÷�Ӧ�ġ�H_______0(��>����<��)������Ϊ____________________________��
��ͼ��a���Ӧ�¶��£���֪N2O4����ʼѹǿp0Ϊ108 kPa������¶��·�Ӧ��ƽ�ⳣ��Kp��________________ (��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
(3)���NO2�Ʊ�NH4NO3���乤��ԭ������ͼ��ʾ��

�������ĵ缫��ӦʽΪ____________________________________________________��
��Ϊʹ������ȫ��ת��ΪNH4NO3���貹��ij�ֻ����������A����A�Ļ�ѧʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾAlCl3��Һ��NaOH��Һ�μӹ������������Ĺ�ϵ���ߡ� �ж�����˵������ȷ���ǣ� ��
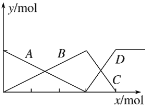
A.A�߱�ʾAl3�������ʵ����ı仯
B.x��ʾNaOH�����ʵ���
C.C�߱�ʾAl(OH)3�����ʵ����ı仯
D.D�߱�ʾAl(OH)3�����ʵ����ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����;�㷺�ľ�ϸ������Ʒ����ҵ�������������ķ����ܶ࣬��ͼ��

����˵����ȷ����
A. ��Ӧ�١��ھ���ȡ����Ӧ
B. ��Ӧ�ۡ��ܵ�ԭ�������ʾ�Ϊ100��
C. ������������Ϊͬ���칹������������2��
D. �Ҵ������ᡢ��������������ɫҺ�����Na2CO3��Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������,��һ�����İ�������������ܱ����������(����������Բ���)������Ӧ��H2NCOONH4(s)![]() 2NH3(g)+CO2(g)��H,�ﵽƽ��ʱ���c(CO2)=amol��L-1���¶Ȳ���,�ﵽƽ���ѹ�����������ԭ����һ��,�ﵽ��ƽ��ʱ���c(NH3)=xmol��L-1������˵����ȷ������ ��
2NH3(g)+CO2(g)��H,�ﵽƽ��ʱ���c(CO2)=amol��L-1���¶Ȳ���,�ﵽƽ���ѹ�����������ԭ����һ��,�ﵽ��ƽ��ʱ���c(NH3)=xmol��L-1������˵����ȷ������ ��
A. ��������ƽ����Է����������ٱ仯ʱ�����ﵽƽ��״̬
B. �ﵽ��ƽ��ʱ����HΪԭ����2��
C. ������Ӧ�ﵽ��ƽ��״̬ʱx=2a
D. ������Ӧ��ϵ�У�ѹ���������������n(H2NCOONH4)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ؿ��γɶ��ֻ�����ڹ�ҵ�����о�����Ҫ��ֵ����ش��������⣺
(1)һ���¶��£���һ������N2��H2����̶�������ܱ������н��кϳɰ���Ӧ��
������������˵���ÿ��淴Ӧ�ﵽ��ѧƽ��״̬����__��
A.������������ܶȲ���
B.c(N2)��c(H2)��c(NH3)=1��3��2
C.�����ڵ�ѹǿ����
D.��ͬʱ������3molH-H�����ѣ���6molN-H���γ�
E.3v��(H2)=2v��(NH3)
F.�����������ƽ����Է�����������
�ں��º�ѹ�����£�Ϊ��ߺϳɰ���Ӧ��N2��H2�������ʣ��ɲ��õķ���__(һ�ּ���)��
(2)һ���¶��£�2L�ܱ������г���0.40molN2O4��������Ӧ��N2O4(g)![]() 2NO2(g)��һ��ʱ���ﵽƽ�⣬����������£�
2NO2(g)��һ��ʱ���ﵽƽ�⣬����������£�
ʱ��/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
��20s�ڣ�v(NO2)=__�����¶��·�Ӧ�Ļ�ѧƽ�ⳣ����ֵΪ__��
�������¶�ʱ��������ɫ���������Ӧ��__(��������������������)��Ӧ��
����ͬ�¶��£�����ʼ��������г���0.40mo1NO2����ﵽƽ���c(NO2)__0.15mol/L(����>������=������<��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com