
【题目】已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜. (一)制备苯甲酸乙酯![]() +C2H5OH
+C2H5OH ![]()
![]() +H2O
+H2O
相关物质的部分物理性质如上表格:
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
达到平衡所需要时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化剂 | |
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是 , 反应液中的环己烷在本实验中的作用 . 
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是 .
(3)步骤③碳酸钠的作用是 , 碳酸钠固体需搅拌下分批加入的原因 .
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用 .
(5)步骤⑤蒸馏操作中,下列装置最好的是(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用(水浴加热、直接加热、油浴加热). 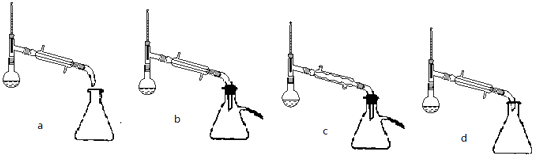
(6)(二)制备苯甲酸铜 将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
混合溶剂中乙醇的作用是 , 趁热过滤的原因
(7)本实验中下列药品不能代替氢氧化铜使用的是
A.醋酸铜
B.氧化铜
C.碱式碳酸铜
D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是
A.冷水
B.热水
C.乙醇
D.乙醇水混合溶液.
【答案】
(1)B;(通过形成水﹣乙醇﹣环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行
(2)分水器中下层(水层)液面不再升高
(3)中和苯甲酸和硫酸;加入过快大量泡沫的产生可使液体溢出
(4)萃取出水层中溶解的苯甲酸乙酯,提高产率
(5)bd;水浴加热
(6)增大苯乙酸的溶解度,便于充分反应;苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(7)D
(8)C
【解析】解:(1)根据步骤②控制温度在65~70℃缓慢加热液体回流,可判断选择水浴加热的方式,要控制水浴的温度,所以温度计应测量水的温度;由于水﹣乙醇﹣环己烷三元共沸物,所以环己烷在本实验中的作用是可以带出生成的水,可使酯化反应正向进行, 所以答案是:B;(通过形成水﹣乙醇﹣环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行;(2)根据反应产物可知,当反应完成时,不再产生水,分水器中下层(水层)液面不再升高,所以反应完成的标志是分水器中下层(水层)液面不再升高,
所以答案是:分水器中下层(水层)液面不再升高;(3)反应物中用了苯甲酸和硫酸,所以加入碳酸钠可以中和酸,酸与碳酸钠反应可以产生泡沫,所以加入的速度不能快,
所以答案是:中和苯甲酸和硫酸;加入过快大量泡沫的产生可使液体溢出;(4)苯甲酸乙酯有少量溶解中水,用乙醚可以将其萃取出来,以提高产率,所以答案是:萃取出水层中溶解的苯甲酸乙酯,提高产率;(5)根据防止产物挥发到空气和冷凝效果选择装置b或d都可以,乙醚的沸点较低,用水浴即可将其蒸出,
所以答案是:bd;水浴加热;(6)苯甲酸微溶于水,使用乙醇可以增大苯甲酸的溶解度,便于充分反应;苯甲酸铜冷却后会结晶析出,所以要趁热过滤,
所以答案是:增大苯乙酸的溶解度,便于充分反应;苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品;(7)氢氧化铜能与苯甲酸反应,所以要替代氢氧化铜的物质应该能与酸反应,硫酸铜不能与酸反应,
故选D;(8)洗涤苯甲酸铜晶体时,既要除去表面可溶性杂质,又要尽可能减小苯甲酸铜晶体的溶解,且便于干燥,苯甲酸铜易溶于水,难溶于乙醇,
故选C.


科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4 , 无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为 , 其中氮的化合价为 .
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 .
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭推进剂的主要原因为 .
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为 .
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( ) 
A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3﹣)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)+c(H+)=c(OH﹣)+2c(CO32﹣)+c(H2CO3)
C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Kb(NH3H2O)>Ka1(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂按如下步骤进行生产:①以煤为燃料煅烧碳酸钙;②用饱和Na2CO3溶液吸收步骤①中产生的CO2(转化为小苏打NaHCO3);③使步骤①中产生的CaO跟水反应生成消石灰;④消石灰跟Na2CO3溶液反应,所得产品之一循环利用.下列说法不正确的是( )
A.生产过程中没有涉及到氧化还原反应
B.生产过程中没有涉及到置换反应
C.该厂生产的主要原料为煤、纯碱
D.该厂生产的最终产品是小苏打及烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2 , 恰好使溶液中的SO42﹣离子完全沉淀;如加入足量强碱并加热可得到c mol NH3 , 则原溶液中的Al3+浓度(mol/L)为( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去.为研究其组成,某小组同学进行了如下实验. 
又知,甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定
(1)甲中所含阳离子的结构示意图 , 甲的化学式
(2)写出 ①中产生黄色沉淀的反应的离子反应方程式
(3)乙能使品红溶液褪色的原因是
(4)甲的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,试写出该反应的化学反应方程式
(5)下列物质中可能在溶液中与甲反应的是
A.NaI
B.Cl2
C.AgNO3
D.NaOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.粗硅 ![]() SiCl4
SiCl4 ![]() Si
Si
B.Mg(OH)2 ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
C.Fe2O3 ![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
D.AgNO3(aq) ![]() ?[Ag(NH3)2]OH(aq)
?[Ag(NH3)2]OH(aq) ![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,在纺织、造纸、化工合成方面都有重要的用途.
(1)工业上电解饱和食盐水制取氯气:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为L,工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式 .
2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为L,工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式 .
(2)实验室用MnO2与浓盐酸共热制氯气,试写出该反应的化学方程式 , 若用100mL 12molL﹣1的浓盐酸与足量的MnO2反应,则生成的氯气在标准状况下的体积6.72L(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式:S(s)+O2(g)===SO2(g) ΔH=a kJ·mol-1 (a=-297.2)。分析下列说法,其中不正确的是 ( )
A. S(s)在O2(g)中燃烧的反应是放热反应
B. S(g)+O2(g)===SO2(g) ΔH=b kJ·mol-1,则a>b
C. 1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和
D. 16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com