
【题目】已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用下图所示的实验装置来制备纯净、干燥的氯气,并实验其与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )

A.①和②处B.只有②处
C.②和③处D.②、③、④处
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】能源是人类可持续发展面临的重要问题,某科学家设计的UT-3热化学循环如下图所示:
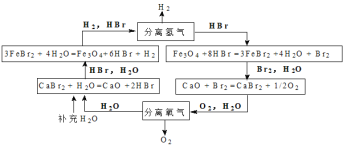
该过程最终制得的能源气体是
A.H2B.O2C.HBrD.Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿(主要成分是二氧化锰)制高锰酸钾的流程如下(部分条件和产物省略):
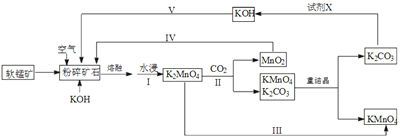
请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有______________________。
(2)写出向二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:___________________________________。
(3)从经济性考虑试剂X宜选择(填名称):___________。上述流程中,设计步骤IV和V的目的是____________________________________。
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为___________________。
②电解过程中,阴极附近电解质溶液的pH将_______(填:增大、减小或不变)。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色时,达到滴定终点。写出离子方程式:__________________。
(6)已知:常温下,Ksp [Mn(OH)2]=2.010-13。工业上,调节pH沉淀废水中Mn2+。当pH=10时,溶液中c(Mn2+)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F有以下转化关系。A的产量可以衡量一个国家的石油化工发展水平;E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F为高分子化合物。结合如图关系回答问题:
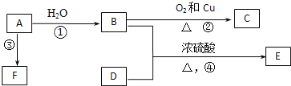
(1)写出C的结构简式:___________
(2)写出B、D中官能团的名称:B____________,D_____________.
(3)写出下列反应的化学方程式:
②____________
④____________
(4)有机化合物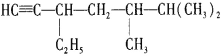 的名称是____________,将其在催化剂存在下完全与H2加成,所得烷烃的名称是___________
的名称是____________,将其在催化剂存在下完全与H2加成,所得烷烃的名称是___________
(5)相对分子质量为72且沸点最低的烷烃的结构简式为________
(6)乙醇的分子结构为: ,分子内脱水生成乙烯时,断开的键是______(填编号。下同);在铜催化作用下发生催化氧化反应时,断开的键是____;酯化反应时,断开的键是______
,分子内脱水生成乙烯时,断开的键是______(填编号。下同);在铜催化作用下发生催化氧化反应时,断开的键是____;酯化反应时,断开的键是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中,在不同条件下,既能发生水解反应和消去反应,又能发生酯化反应并能与金属钠反应放出氢气的是 ( )
①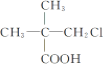 ②
②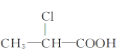 ③
③![]() ④
④
A. ②B. ②③C. ①②D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HIO3是强酸,其水溶液是强氧化剂。工业上,以KIO3为原料可制备HIO3。某学习小组拟用如图装置制备碘酸。M、N为惰性电极,ab、cd为交换膜。下列推断错误的是( )
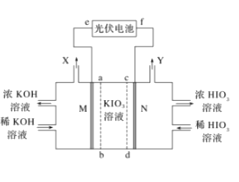
A.光伏电池的e极为负极,M极发生还原反应
B.在标准状况下收集6720mLX和Y的混合气体时KIO3溶液减少3.6g
C.Y极的电极反应式为2H2O-4e-═O2↑+4H+
D.制备过程中要控制电压,避免生成HIO4等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学反应与能量转化的相关知识,试回答下列问题:
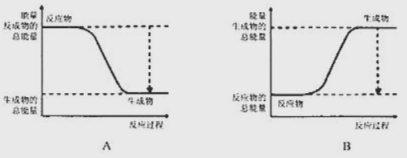
(1)已知![]() ,黑磷比白磷稳定,结构与石墨相似,下图能正确表示该反正中能量变化的是___(填序号)。
,黑磷比白磷稳定,结构与石墨相似,下图能正确表示该反正中能量变化的是___(填序号)。
(2)已知:氢氧燃料电池的总反应方程式为2H2O+O2=2H2O。在碱性条件下,通入氢气一端的电极反应式为_________________。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。
(3)已知断开1mol N≡N键需要946kJ的能量,断开1mol H—H键需要436kJ的能量,生成1moN—H键放出391kJ的能量,试计算生成2mol NH3时会______(填“放出”或“吸收”)______kJ能量。当在相同的条件下向容器中充入1molN2和3molH2时,它们反应对应的热量______(填“大于”、“等于”或“小于”)你所计算出的值,原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com