
����Ŀ��ij�ܱ������г�������ʵ���������A��B��һ���¶��·�����Ӧ��A(g)��xB(g) ![]() 2C(g)�ﵽƽ���ֻ�ı䷴Ӧ��һ��������������������ʵ�Ũ�ȡ���Ӧ������ʱ��仯�Ĺ�ϵ����ͼ��ʾ����ش��������⣺
2C(g)�ﵽƽ���ֻ�ı䷴Ӧ��һ��������������������ʵ�Ũ�ȡ���Ӧ������ʱ��仯�Ĺ�ϵ����ͼ��ʾ����ش��������⣺

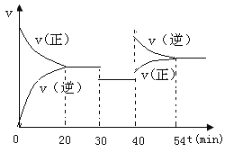
��1��0��20min��A��ƽ����Ӧ����Ϊ_________________��8minʱ��v(��)___v(��)���>��=��<��
��2����Ӧ����ʽ�е�x��_______��30minʱ�ı�ķ�Ӧ������________________________��
��3��20��30minʱ��Ӧ��ƽ�ⳣ��_______30��40minʱ��Ӧ��ƽ�ⳣ�����>��=��<����
��4���÷�Ӧ������ӦΪ________��������ȡ������ȡ�����Ӧ��
��5����Ӧ������B��ת��������ʱ�����__________________min��
���𰸡�0.05 mol L-1min-1 > 1 ����������������Сѹǿ�� = ���� 20��40
��������
��1����ͼ���֪����Ӧ�ӿ�ʼ��20min��A��Ũ�ȼ�����1mol/L����A��ƽ����Ӧ����Ϊ![]() =0.05 mol/(Lmin)��8minʱδ�ﵽƽ�⣬��Ӧ������Ӧ������У���v(��)��v(��)��
=0.05 mol/(Lmin)��8minʱδ�ﵽƽ�⣬��Ӧ������Ӧ������У���v(��)��v(��)��
��2��30minʱ�����ı�˲�䣬Ũ��ͬ�ȱ�����С�����淴Ӧ���ʶ���С������Ӧ��������ȣ�ƽ�ⲻ�ƶ�����Ӧ�����������������Сѹǿ��ԭ�÷�Ӧǰ�������������䣬��x=1��
��3��20-30min��30-40min��ʱ������¶�û�䣬ƽ�ⳣ�����䣻
��4��40minʱ�ı�������C��Ũ�ȼ�С��A��Ũ�����ӣ�˵��ƽ�����淴Ӧ������У���ͼ��֪�������ı�����淴Ӧ���ʾ�����ֻ�������¶����������������ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
��5��20-30min��30-40min��ʱ�������������ͬ����ƽ��δ�ƶ���40-54minƽ�����淴Ӧ�����ƶ���B��ת���ʼ�С����20-30min��30-40minB��ת�������20��40minת�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں������Է�ˮ���õ�ⷨ����ʵ�����϶������õ��Ȼ��ƣ���װ����ͼ��ʾ�����������������

A. ������������
B. ѡ�������滻̼��������Ч������
C. ͨ����м���ҵ�NaCl��ҺŨ������
D. �����ĵ缫��ӦʽΪ4OH- �� 4e-=O2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ���й�����,���������ʵ����ı仯�����ͼ��ʾ������˵����ȷ����
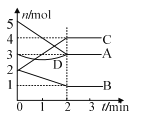
A. C��D��������
B. ��Ӧ�ķ���ʽΪ2A + B![]() 2C
2C
C. 2 min������ʵ������ٱ仯
D. �÷�Ӧ���ǿ��淴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����A��B�ж�����2molX��2molY����ʼVA=0.8a L��VB=a L�����¶Ȳ��䣬���д����������£��������и��Է������з�Ӧ��X(g)+Y(g)![]() 2Z(g)+W(g)�ﵽƽ��ʱ��VA=0.9a L��������˵��������� ( )
2Z(g)+W(g)�ﵽƽ��ʱ��VA=0.9a L��������˵��������� ( )
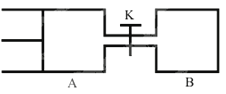
A. �������дﵽƽ���ʱ��A<B
B. ��K�ﵽ��ƽ�������B�����¶�,A����������ԭƽ��״̬ʱһ������
C. A������X��ת����Ϊ25%���ұ�B�����е�X��ת����С
D. ��Kһ��ʱ���ƽ��ʱ��A�����Ϊ0.8a L����ͨ���е�����������ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ�50mL 0.50mol/L������50mL 0.55mol/LNaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ���ش��������⣺
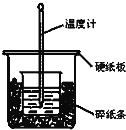
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������___________��
��2�����ձ����������Ӳֽ�壬��õ��к�����ֵ__________������ƫ��������ƫС��������Ӱ��������
��3��ʵ���и���60mL 0.50mol/L�����50mL 0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ������к���________�������������������������������ɣ�______________________��
��4��������Һ���ܶȶ���1g/mL���кͺ�������Һ�ı�����c=4.18J/��g���棩������ƽ�в��������ֹ�¶�����ʼ�¶Ȳt2��t1���ֱ�Ϊ����3.2�� ��2.2�� ��3.0�棬д����ʾ������NaOH��Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ________________________����С�������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼ��ⱥ��ʳ��ˮ��ȡ�Ĺ�������ͼ���£�
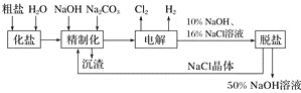
(1)�ڵ������У����Դ���������ĵ缫����������Ӧ�ĵ缫��ӦʽΪ______________�����Դ���������ĵ缫����������Ӧ�ĵ缫��ӦʽΪ__________________��
(2)��ҵʳ�κ�Ca2����Mg2�������ʣ����ƹ����з�����Ӧ�����ӷ���ʽΪ________________________________________________________________________��
(3)���������![]() �����ϸߣ��������ӱ��Լ���ȥ
�����ϸߣ��������ӱ��Լ���ȥ![]() ���ñ��Լ�������______(����ĸ)��
���ñ��Լ�������______(����ĸ)��
a��Ba(OH)2��������b��Ba(NO3)2��������c��BaCl2
(4)Ϊ��Ч��ȥCa2����Mg2����![]() �������Լ��ĺ���˳��Ϊ________��
�������Լ��ĺ���˳��Ϊ________��
a���ȼ�NaOH�����Na2CO3���ټӱ��Լ�
b���ȼ�NaOH����ӱ��Լ����ټ�Na2CO3
c���ȼӱ��Լ������NaOH���ټ�Na2CO3
(5)���ι���������NaOH��NaCl���ܽ���ϵIJ��죬ͨ��________����ȴ���ᾧ��________(��д��������)��ȥNaCl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ų��ķ�ˮ�к��д�����Fe2+��Cu2+��SO42-��
��.ijУ�о���ѧϰС�������ͼ���������Ի���ͭ��������������ش�:

(1)����ԭ�Ϣٷ�Ӧ�����ӷ���ʽΪ_____
(2)���������õ��IJ���������_____(�����)��
a.�ձ� b.©�� C.������ d.�ƾ���
(3)����ԭ�Ϣڵ�����Ϊ_____
��.���յ�ͭ�������Ʊ�����(CuSO45H2O)����ͭ��һ��Ũ��ϡ�����Ϻ��ڼ��ȵ������ͨ���������������·�Ӧ:2Cu+2H2SO4+O2�T2CuSO4+2H2O���Ƶ�����ͭ��Һ��������Ũ����ȴ�ᾧ�����˿ɵõ���
(1)�����2Cu+2H2SO4+O2![]() 2CuSO4+2H2O��Ӧ�У���������_____����������_____(�ѧʽ)
2CuSO4+2H2O��Ӧ�У���������_____����������_____(�ѧʽ)
(2)��˫���ű����Ӧ�е���ת�Ƶķ������Ŀ______________________
(3)����147gH2SO4���뷴Ӧ����Ӧת�Ƶĵ�����ĿΪ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g)����H= ��1025kJ/mol���÷�Ӧ��һ�����淴Ӧ������Ӧ����ʼ�����ʵ�����ͬ�����й��ڸ÷�Ӧ��ʾ��ͼ����ȷ����
A. 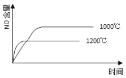
B. 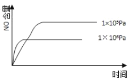
C. 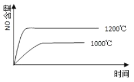
D. 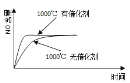
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com