
【题目】下列各组中的离子,在溶液中无色且能大量共存的是( )
A. K+、Ba2+、SO42-、OH-B. Na+、Cu2+、Cl-、SO42-
C. Na+、NH4+、OH-、HCO3-D. Na+、Ca2+、Cl-、NO3-
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。其制备方法有:
(1)方法一:用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。请写出该反应的化学方程式___________________________________________。
(2)方法二:用氯酸钠氧化浓盐酸,生成二氧化氯的同时会有氯气产生。请写出该反应的化学方程式_____________________________________。
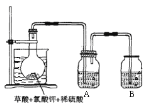
(3)方法三、
①如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),
然后再加入足量的稀硫酸,水浴加热。反应后产物中有
ClO2、CO2和一种酸式盐,该反应的化学方程式为:__________________________________,
氧化产物与还原产物的物质的量之比为____________。
②控制水浴温度在60~80℃之间的目的是_______________________,
图示装置中缺少的一种必须的玻璃仪器是____________。
③A装置用于吸收产生的二氧化氯,其中最好盛放________。(填序号)①60 ℃的温水 ②冰水 ③饱和食盐水
④将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如下图所示,下列说法中错误的是( )

A. 盐酸的体积为80mlB. a的取值范围为0≤ a <50
C. n(Mg2+)<0.025molD. 当a值为30时,b值为0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀____________(填操作名称)、洗涤、烘干、称量、计算。洗涤沉淀的具体操作是_____________________________。
方案二:把一定量的样品与足量硫酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用_________________。下图装置中实验仪器a的名是_________________。

方案三:利用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
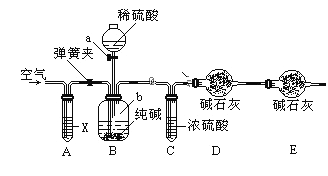
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g。
(1)若④⑤两步的实验操作太快,则会导致测定结果__________(填“偏大”或“偏小”)。
(2)装置A中试剂X应选用________________________。
(3)E装置的作用是_______________________________。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为___________(结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A. Mg在CO2中的燃烧是置换反应
B. 将Mg(OH)2沉淀转化为MgCl2,是镁原子失电子转化为Mg2+
C. 电解得到镁的过程可以写出离子反应方程式,但不是氧化还原反应
D. Mg在CO2中燃烧的反应中,CO2既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图两套基础实验装置回答问题。
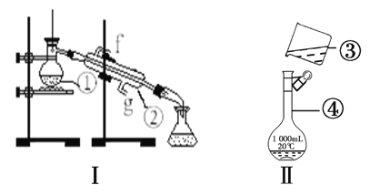
(1)写出下列仪器的名称:______________、___________________。
(2)仪器①~④中,使用时必须检查是否漏水的有____________________。(填序号)
(3)用装置I制蒸馏水,还缺少的仪器有_________,冷却水从_______口进。
(4)a.现需配制250mL0.2molL-1NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是_______________,_______________。
b.配制过程中,下列情况会使配制结果偏高的是________________(填序号)。
①定容时俯视刻度线观察液面;②容量瓶使用时未干燥;③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;④移液时未洗涤烧杯和玻璃棒
c.若实验中加蒸馏水时不慎超过了刻度,应如何处理?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3
A.③④B.①②③④C.①③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________。
(2)上述反应中氧化剂是______(填化学式),被氧化的元素是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断不正确的是

A. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
B. 该反应的化学方程式为3Z ![]() 3X+2Y
3X+2Y
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
D. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com