
【题目】把一块镁铝合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如下图所示,下列说法中错误的是( )

A. 盐酸的体积为80mlB. a的取值范围为0≤ a <50
C. n(Mg2+)<0.025molD. 当a值为30时,b值为0.01
【答案】D
【解析】
根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+OH-=AlO2-+2H2O,从横坐标80mL到90mL这段可以求出n[Al(OH)3]=0.01mol。
A.第一阶段,盐酸和氢氧化钠反应:H++OH-=H2O;第二阶段,氯化镁和氯化铝和氢氧化钠反应Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,在加入V(NaOH)=80mL时,溶液中溶质全为NaCl,可以看出氢氧化钠与盐酸物质的量相等,求出盐酸的体积为80mL,故不选A;
B.第三阶段,氢氧化铝溶解Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,所以第一阶段和Al3+反应的NaOH为30mL,假设无Mg2+,a=50,而实际存在Mg2+,所以0<a<50,故不选B;
C.第三阶段,氢氧化铝溶解Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值,第一阶段,和Al3+反应的NaOH为30mL,所以此时和Mg2+反应的NaOH为50ml,n(Mg2+)最大值=0.025mol,而如图所示a>0,所以n(Mg2+)<0.025mol,故不选C;
D.a=30时,和Mg2+反应的NaOH为20ml,此时n(Mg2+)=0.01mol,b=n(Mg2+)+n(Al3+)=0.02mol,故D错误;
答案:D。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】把500 mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A. 0.1(b-2a)mol/L B. 10(2a-b)mol/L
C. 10(b-a)mol/L D. 10(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )
A. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
B. 蚕丝属于天然高分子材料
C. “蜡炬成灰”过程中发生了氧化反应
D. 蚕丝的主要成分是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的叙述,正确的是( )
A. 非金属元素原子之间形成的一定是共价键
B. 离子化合物中一定含有离子键
C. 单质分子中一定存在化学键
D. 含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6 LH2(标准状况下)。
①合金中镁的物质的量_________。
②写出该合金溶于足量NaOH溶液的化学方程式_________________。同时产生H2的体积(标准状况下)为____________ 。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的平均相对分子质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为____________ (计算结果保留1位小数) 。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_______________ (计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组对金属钠进行了研究。已知C、D都是单质,F的水溶液是一种常见的强酸。
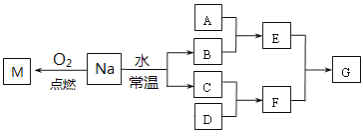
(1)F的名称是:______________
(2)金属Na在空气中放置足够长时间,最终的生成物是:________________
(3)该小组同学应该如何取用金属钠:_________________________________________
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出该过程的离子方程式:___________________

(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如右图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为__________________________。
(7)将NaHCO3与M的混合物在密闭容器中充分加热后排出气体,经测定,所得固体为纯净物,则NaHCO3与M的质量比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,在溶液中无色且能大量共存的是( )
A. K+、Ba2+、SO42-、OH-B. Na+、Cu2+、Cl-、SO42-
C. Na+、NH4+、OH-、HCO3-D. Na+、Ca2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S═K2S+2NO2↑+CO2↑.其中被还原的元素是_____,还原剂是_____,若参加反应的碳为6克,则反应中转移的电子是___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com