
【题目】火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S═K2S+2NO2↑+CO2↑.其中被还原的元素是_____,还原剂是_____,若参加反应的碳为6克,则反应中转移的电子是___mol。
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如下图所示,下列说法中错误的是( )

A. 盐酸的体积为80mlB. a的取值范围为0≤ a <50
C. n(Mg2+)<0.025molD. 当a值为30时,b值为0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3
A.③④B.①②③④C.①③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________。
(2)上述反应中氧化剂是______(填化学式),被氧化的元素是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置可以用于NH3、SO2等气体的制备。

请回答下列问题:
(1)若用Ca(OH)2固体和NH4Cl固体制取少量NH3,则选用的装置是_____(填序号)产生NH3的化学方程式为__________________________________,干燥NH3可以用____________(试剂名称),检验集气瓶中是否收集满氨气的方法是____________________________________。
(2)若用铜与浓硫酸反应制取SO2,应选用装置________(填序号),产生SO2的化学方程式为_____________________________________________________。(填序号)
下列溶液能直接用于检验SO2气体存在的是__________。
A.酸性KMnO4溶液 B.NaOH溶液 C.Na2CO3溶液 D.品红溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的核外电子排布式为___________,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________,与其为等电子体的分子是___________
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
(3)单质铜及镍都是由____键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是______________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为____________。
②若合金的密度为d g·cm–3,晶胞参数a=__________nm。
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3和NH3键角不同,其中键角较大的是____________,其原因是_______________________。且NF3不易与Cu2+形成配离子,其原因是:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断不正确的是

A. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
B. 该反应的化学方程式为3Z ![]() 3X+2Y
3X+2Y
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
D. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列各实验装置的叙述中,不正确的是
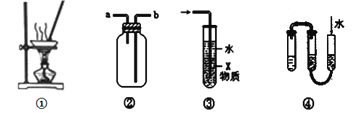
A. 装置①可用蒸发操作,蒸干FeSO4溶液获取FeSO4·7H2O晶体
B. 装置②可用于收集H2、Cl2、SO2、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④所示方法可检查该装置的气密性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com