
����Ŀ����NAΪ�����ӵ�������ֵ,����˵����ȷ����
A. 120g NaHSO4�������NA��SO42-
B. 6.2 g�����ƺ�7.8 g�������ƵĻ�����к��е�����������Ϊ0.2NA
C. 4.6g����������������С�ף�������ˮ��ַ�Ӧ��������������Ϊ0.1NA
D. NH4Cl+NaNO2=N2��+NaCl+2H2O��ÿ����0.1mol N2��ת�Ƶ�����Ϊ0.6NA
���𰸡�B
��������
A��NaHSO4�����������Ӻ����������ɣ�������SO42-����A����
B��6.2 g�����Ƶ����ʵ���Ϊ![]() =0.1mol��7.8 g�������Ƶ����ʵ���Ϊ
=0.1mol��7.8 g�������Ƶ����ʵ���Ϊ![]() =0.1mol������������������������Ӹ�����Ϊ1���ʶ��ߵĻ�����к��е�����������Ϊ0.2 NA����B��ȷ��
=0.1mol������������������������Ӹ�����Ϊ1���ʶ��ߵĻ�����к��е�����������Ϊ0.2 NA����B��ȷ��
C��4.6 g���൱��0.2mol�ƣ�0.2mol����ˮ��Ӧ���ɵ����������ʵ���Ϊ0.1mol��ͬʱ��Ӧ���ɵ������������������ܷ�Ӧ������������������ˮ��ַ�Ӧ������������������0.1NA����C����
D��NH4Cl+NaNO2=N2��+NaCl+2H2O ��Ӧ��NԪ�صĻ��ϼ۷ֱ���-3�ۺ�+3�۱��0�ۣ�ÿ����lmolN2ת�Ƶĵ��ӵ����ʵ���Ϊ3mol������ÿ����0.1molN2ת�Ƶĵ�����Ϊ0.3NA����D����
��ѡB��


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��400��ʱ����һ������SO2��14molO2ѹ��һ��ʢ�д�����10L�ܱ������н��з�Ӧ��2SO2��O22SO3����֪2minʱ��������ʣ��2molSO2��12molO2���Լ��㣺
(1)SO2����ʼ���ʵ���Ũ��__________________��
(2)2min��SO3�ķ�Ӧ����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�����ܺ���Al3+��Ba2+��NH4+��Fe2+��Na+��CO32����SO42����SiO32����NO3���е�һ�ֻ������ӣ�ȡ����Һ����ʵ�飬������ת������ͼ��ʾ��

��ش��������⣺
(1)�������ʵ����̿��ж���ҺX��һ�������ڵ���������______��
(2)��������A�����ӷ���ʽΪ____________��
(3)��ʵ�������ռ�����A����ѡ����ͼװ���е�______��
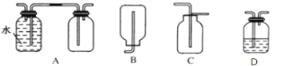
(4)д���ܷ�Ӧ��������ҺH�����ӷ���ʽ____________��
(5)�Բ���ȷ���Ƿ���ڵ����ӣ���������ʵ�鷽��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ȡ300mL 0.2mol/L��KI��Һ��һ����������KMnO4��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3��������KMnO4�����ʵ�������_________mol��
(2)��Fe(NO3)3��Һ�м���Na2SO3��Һ����Һ�����ػ�ɫ��Ϊdz��ɫ����һ���ֱ�Ϊ�ػ�ɫ����Һ�ȱ�Ϊdz��ɫ�����ӷ���ʽ��____________���ֱ�Ϊ�ػ�ɫ��ԭ���������ӷ���ʽ����____________��
(3)��100mL FeBr2��Һ��ͨ������2.24LCl2����Һ����1/4��Br-�������ɵ���Br2����ԭFeBr2��Һ��FeBr2�����ʵ���Ũ��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ��д�������
A.�Ҵ���������ȡ��ȩ��2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B.��ϩʹ������Ȼ�̼��Һ��ɫ��CH2=CH2+Br2��CH2Br��CH2Br
C.CH4��Cl2��Ϻ���գ�CH4��Cl2![]() CH2Cl2��H2
CH2Cl2��H2
D.������Ҵ�������Ӧ��������������CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl�����������бز����ٵ����ʡ���NaCl����ˮ���1 mol��L-1����Һ���ܽ������ͼ��ʾ������˵����ȷ����
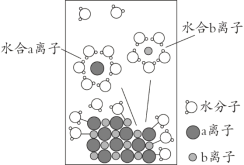
A. a����ΪNa+
B. ��Һ�к���NA��Na+
C. ˮ��b���ӵ�ͼʾ����ѧ
D. �����²ⶨ��NaCl��Һ��pHС��7��������Cl-ˮ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����K2Cr2O7��Һ����FeSO4��Һ��Ӧ����Fe3����Cr3�����ֽ������ữ��K2Cr2O7��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3�������ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ������˵���в���ȷ����
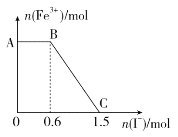
A. ͼ��AB�ε�������ΪK2Cr2O7
B. ��ʼ�����K2Cr2O7Ϊ0.25 mol
C. K2Cr2O7��FeSO4��Ӧ�����ʵ���֮��Ϊ1��3
D. ͼ��BC�η����ķ�ӦΪ2Fe3����2I��===2Fe2����I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���������
A.3.6 g C60��C50��ɵĻ�����С����еĵ�����ĿΪ1.8NA
B.6.72 L(��״��)Cl2���������鷴Ӧʱ�����ѵ�C-H����ĿΪ0.3NA
C.0.1 LŨ�Ⱦ�Ϊ2 mol/L��(NH4)2SO4��NH4Cl��Һ�У�NH4+��Ŀǰ�߱Ⱥ��߶�0.2 NA
D.0.1 mol H3BO3[���뷽��ʽ��H3BO3+H2O![]() H++B(OH)4-]����OH-��Ŀ���Ϊ0.1 NA
H++B(OH)4-]����OH-��Ŀ���Ϊ0.1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Zԭ�Ӱ뾶��˳��Ϊ![]() ����̬Xԭ��p�ܼ��ϵĵ�������Yԭ����������3�������ǿ����γ����ӻ�����
����̬Xԭ��p�ܼ��ϵĵ�������Yԭ����������3�������ǿ����γ����ӻ�����![]() ������������
������������![]() (��֪
(��֪![]() ˮ�����
ˮ�����![]() Ϊ
Ϊ![]() ��
��![]() Ϊ
Ϊ![]() )�Ľṹ��ͼ��ʾ�����������������( )
)�Ľṹ��ͼ��ʾ�����������������( )

A.![]() �����������Ӿ�����18������
�����������Ӿ�����18������
B.�����£�![]() ��ˮ��Һ�ʼ���
��ˮ��Һ�ʼ���
C.����Ԫ����Y�ĵ縺����С
D.����̬�⻯��Ļ�ԭ�ԣ�![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com