
【题目】某原电池装置如右图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( )

A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减
少0.02 mol离子
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X 、Y 、Z 、W
(2)由以上元素中的两种元素组成的能溶于水且水溶液弱显碱性的化合物的电子式为 。
(3)由X、Y、Z所形成的离子化合物是 ,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H
CH3OH(g)+ H2O(g) △H
现在体积为1L的密闭容器中,充入CO2和H2。实验测得反应体系中物质的物质的量与时间关系如下表,
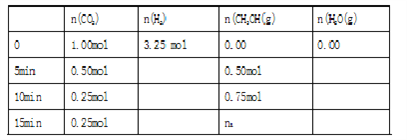
回答下列问题:
(1)表格中的n1=______________
(2)0-5min内 v (H2)=_______________
(3)该条件下CO2的平衡转化率为__________________
Ⅱ.在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g)。一定条件下发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H
CO(g)+3H2(g) △H
已知CH4的转化率与温度、压强的关系如图1所示。回答下列问题:
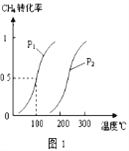
(4)100℃时平衡常数为_________________.
(5)图1中的p1_______p2(填“<”、“>”或“=”),其理由是:_________________
(6)若100℃时该可逆反应的平衡常数是K1,200℃该该可逆反应的平衡常数是K2,则K1___ K2(填“<”、“>”或“=”).其理由是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L定容密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A、B、C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2。下列分析不正确的是
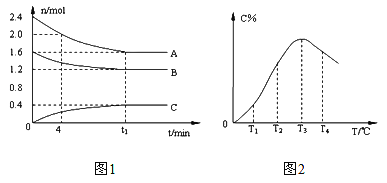
A. t1时刻前,混合气体的密度减小,t1时刻后,混合气体的密度不变
B. 该反应的平衡常数表达式![]()
C. 由T1向T2变化时,V正> V逆
D. 此反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氯气、氢气等非金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 2.24 L CH4中含碳原子数目是0.1 NA
B. 0.1 mol·L-1 NaNO3溶液中含Na+数目是0.1 NA
C. 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA
D. 标准状况下,22.4 L苯中含分子数目是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

在阳极区发生的反应包括 和H ++ HCO3-= H2O + CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下: H2(g) + 1/2 O2(g) ="==" H2O(g) ΔH1=" -242" kJ/mol
CH3OH(g) + 3/2 O2(g) ="==" CO2(g) + 2 H2O(g) ΔH2=" -676" kJ/mol
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。

(3)在密闭的再生装置中,加入5 mol H2与2 mol CO2发生反应生成甲醇,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示,下列说法正确的是

A.P1> P2> P3>P4 |
B.甲醇的物质的量分数越高,反应的平衡常数越大 |
C.图示中,该反应的温度变化为:T1> T2> T3>T4 |
D.T4、P4、时,H2的平衡转化率为60% |
(4)已知某种甲醇燃料电池中,电解质溶液为酸性,示意图如下:

工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com