
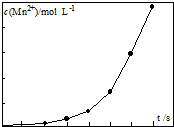
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:
| ||
| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
| ||


科目:高中化学 来源: 题型:
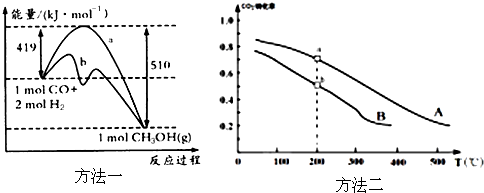
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式
(1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com