(1)已知在常温常压下:
①2CH
3OH(l)+3O
2(g)═2CO
2(g)+4H
2O(g)△H=-1275.6kJ?mol
-1②H
2O(l)═H
2O(g)△H=+44.0kJ.mol
-1写出表示甲醇燃烧热的热化学方程式
.
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景.
| 方法一 |
CO(g)+2H2(g)?CH3OH(g) |
| 方法二 |
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
工业上可用如下方法合成甲醇:
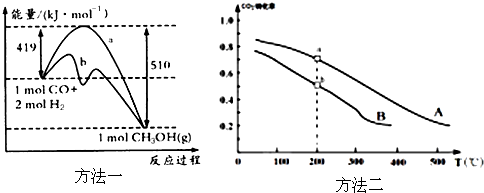
①方法一:该反应的△S
0(填“>”或“<”).图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是
.
A.体系的平均摩尔质量不再改变 B.V(CO)=V(CH
3OH)
C.H
2的转化率达到了最大限度 D.△H不再改变
②方法二:将CO
2和H
2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO
2转化率随温度的变化关系,其中a点的平衡常数表达式为:
;a,b两点化学反应速率别用V
a、V
b表示,则V
a
V
b(填“大于”、“小于”或“等于”). 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的
倍(保留两位小数).
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co
2+氧化成Co
3+,然后以Co
3+做氧化剂把水中的甲醇氧化成CO
2而净化.写出除去甲醇的离子方程式
.




 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下: 在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7.其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.
在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7.其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.