
| A、C2H6O2 |
| B、C2H6O |
| C、C2H4O2 |
| D、C2H4O |
| 10g |
| 100g/mol |
| 2.7g |
| 18g/mol |
| 1.6g |
| 16g/mol |


科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑤ |
| C、②③ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3=Na++CO32- |
| B、Ba(OH)2=Ba2++OH2- |
| C、H2SO4=H2++SO42- |
| D、NaCl=Na++Cl- |
| E、NaCl=Na++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+(a+b)kJ?mol-1 |
| B、+(a-b)kJ?mol-1 |
| C、-(a-b)kJ?mol-1 |
| D、-(a+b)kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酒精灯着火时可用水扑灭 |
| B、为防止试管破裂,加热固体时试管口一般要略高于试管底 |
| C、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,边搅拌条件下边加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4是由极性键构成的非极性分子 |
| B、胶体粒子可以透过滤纸但不能透过半透膜 |
| C、氯水中通入SO2气体发生反应,说明Cl2的氧化性强于S |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
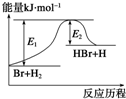
| A、正反应为吸热反应 |
| B、吸热反应一定要加热后才能发生 |
| C、反应物总能量高于生成物总能量 |
| D、升高温度可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
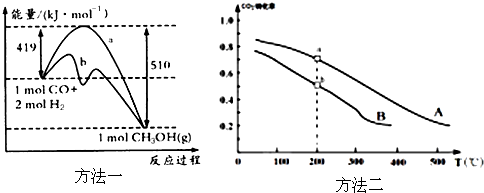
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com