
| A、1.204×1024个O2 |
| B、3molCO2 |
| C、标准状况下89.6LCl2 |
| D、90g水 |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、Na2CO3=Na++CO32- |
| B、Ba(OH)2=Ba2++OH2- |
| C、H2SO4=H2++SO42- |
| D、NaCl=Na++Cl- |
| E、NaCl=Na++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
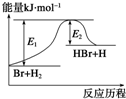
| A、正反应为吸热反应 |
| B、吸热反应一定要加热后才能发生 |
| C、反应物总能量高于生成物总能量 |
| D、升高温度可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、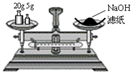 称量氢氧化钠固体 |
B、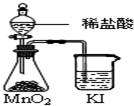 比较MnO2、Cl2、I2的氧化性 |
C、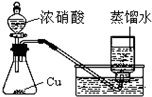 制取少量NO2 |
D、 实验室制取蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编组 | 强电解质 | 弱电解质 | 非电解质 |
| A | NaCl | H2O | Cl2 |
| B | H2SO4 | CaCO3 | CCl4 |
| C | HCl | HClO | 氨水 |
| D | Ba(OH)2 | CH3COOH | C2H5OH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol,甲烷的燃烧热为802 kJ/mol |
| B、等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多 |
| C、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
| D、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
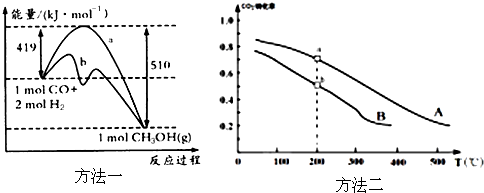
查看答案和解析>>
科目:高中化学 来源: 题型:
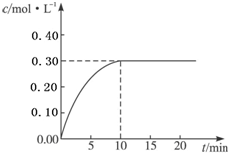 (1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式
(1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com